|
※ 감수인 의견 좋은 보고서 공유해 주셔서 감사 드립니다. 본문 이해를 위해 몇 가지 정보 더합니다. CDI (Clostridioides Difficile Infection)
BLA 제출 이전에는, 제약 회사는 생물학적 제품의 개발 및 시험을 위해 Investigational New Drug (IND) 신청을 FDA에 제출해야 합니다. IND 승인 후, 제품은 임상 시험을 거쳐 안전성과 효능을 입증해야 하며, 이 과정을 통해 축적된 자료를 바탕으로 BLA를 제출합니다. FDA는 BLA를 검토하고, 제품의 허가 여부를 결정합니다.
시한성이 있어 선 게시합니다. 앞으로도 이런 경우가 종종 발생할 텐데요. 바로 게시하는 것이 독자에게 더 도움이 된다고 판단하는 경우, 게시후 감수인 의견을 작성하는 방향으로 진행하려고 합니다. 참고 부탁 드립니다.
(주가가 먼저 반응할 가능성이 있지만) 승인 결과를 댓글로 알려주셨으면 합니다. 감사 드립니다. *앱을 설치하시면, 구독하시는 크리에이터에 대한 새글 알림을 받아보실 수 있습니다. '오렌지보드' 로 검색하셔서 설치 부탁 드립니다. Orangeboard.CT가 작성한 글에 댓글로 피드백 주시면, 고객 본인이 원하는 기능이 적용될 수 있습니다. 참여 부탁 드립니다. |

2018년 빌게이츠는 매년 연초에 진행하는 JP모건 헬스케어 컨퍼런스에서 세상을 바꿀 세가지 기술을 뽑았습니다.
알츠하이머치료제, 면역항암제 그리고 오늘 이야기할 마이크로바이옴 입니다.
앞 2개는 이미 친숙한 단어입니다. 빌게이츠가 언급한 이후 현재 알츠하이머치료제는 최근 엄청 많이 연구되고 있으며, 아직 완벽한 약은 없지만 지속해서 FDA에 승인받고 활발히 개발중에 있습니다.
면역항암제는 뭐 이제 완전히 상용화된 항암제로 머크의 키트루다가 해당시장을 거의 정복했죠.
그럼 마이크로바이옴(Microbiome)은 무엇일까요?
마이크로바이옴은 '미생물(microbe)' 과 '생물군(biome)'의 합성어로 '장내 미생물'을 의미하는데 '마이크로 바이옴은 인간 몸속에 공존하는 미생물의 유전정보 전체를 말합니다.
우리 몸속에는 약 39조개의 미생물이 살고있다고 하고, 그중 대부분은 대장을 포함한 소화기관에 존재한다고 합니다. 전체 미생물의 무게는 대략 체중의 1~3% 정도 밖에 안되지만, 장속의 마이크로바이옴은 인간 유전자보다 150배 많은 유전자를 보유하고 있다고 합니다. 따라서 마이크로바이옴을 제2의 유전자, Second genome으로 부르기도 합니다.
미생물의 90%는 장에서 서식하고 있는데, 미생물들이 소화 뿐만 아니라 면역반응과 같은 다양한 인체 기능에 관여합니다.
장내 미생물이 굉장히 많은 종류가 우리 몸 속에 살고 있는데 평소에는 서로 균형이 이루며 몸에 이로운 작용을 하는데요, 어떤 특별한 이유로 장내 미생물의 환경이 악화해 몸에 안 좋은 균이 우세하고 되고 몸이 좋은 균이 죽게 되면서 여러 가지 병을 일으키는 그런 현상이 벌어지게 됩니다. 이런 측면에서 장내 미생물의 균형을 회복하는 방식의 마이크로바이옴 치료제가 개발이 되고 있는 그런 치료제를 마이크로바이옴 치료제라고 부릅니다.
오늘 소개해 드릴 Seres therapeutics는 마이크로바이옴 치료제 개발회사로 가장 앞서나가고 있는 대표기업입니다.

세레스 테라퓨틱스는 나스닥에 상장되어 있으며, 현재 시가총액 8억달러(1조 800억원정도)입니다.
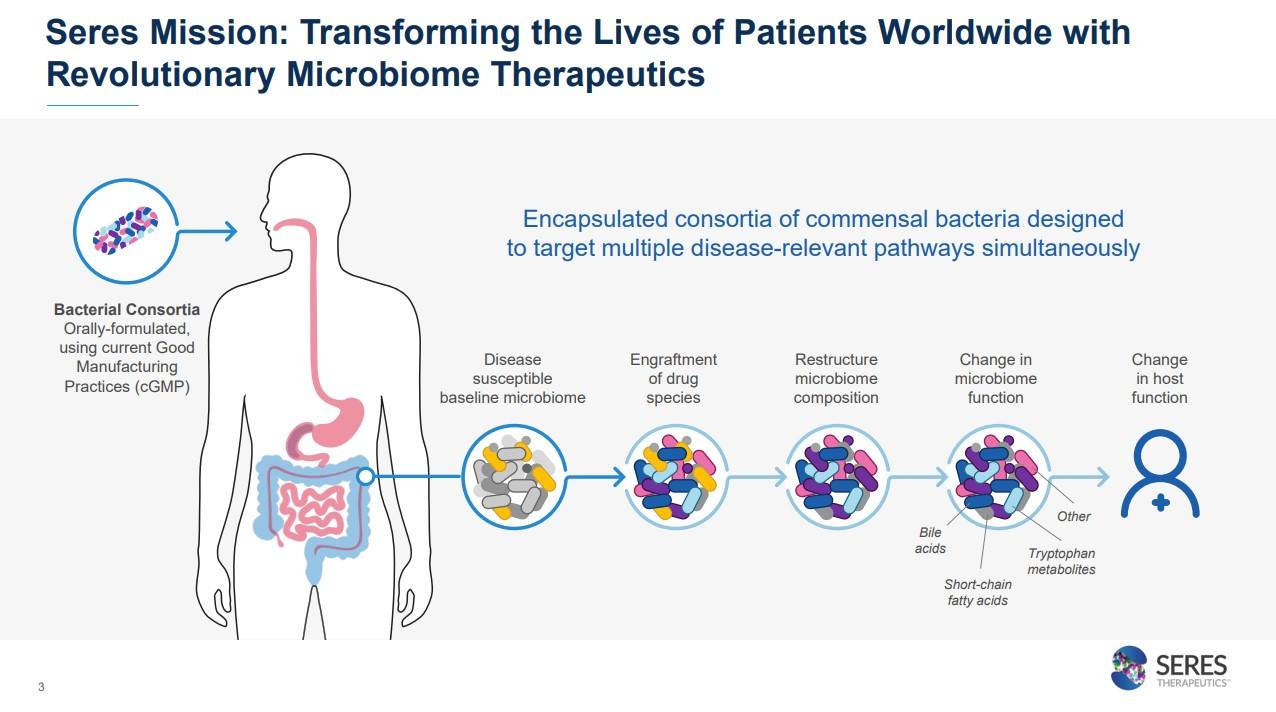
전 세계 환자의 삶을 변화시키는 혁신적인 마이크로바이옴 치료제 개발을 미션으로 가지고 있는 회사입니다.
특히나 이 회사의 특징적인 기술은 캡슐화된 경구제형 치료제라는 점입니다. 이 부분이 왜 강점이 되는지는 밑에 다시 적도록 하겠습니다.

이 회사의 전략적인 우선순위에 대해 살펴보면,
첫번째로, 잠재적으로 first in class인 경구용 마이크로바이옴 치료제 SER-109를 성인 재발성 CDI(Recurrent
C. difficile Infection) 환자에게 제공하는 것.
두번째로, Infection protection에서 기회를 최대화하는 것
세번째로 궤양성 대장염 및 immune modulation에 대한 연구를 계속하는 것 등 입니다.
이 중에서 가장 핵심적인 것은 단연 첫번째인 성인 재발성 CDI 치료제인 SER-109일텐데요. 현재 SER-109는 BLA(Biologics License Application : 바이오의약품 신약 허가) 신청을 완료한 상태이고, 이 글이 올라올 시기 근방인 23년 4월 26일(미국시간)에 승인여부에 대한 결과가 나올 예정입니다.
현재 매우매우 결과가 임박한 상황이죠. FDA승인 이후 곧 런칭이 예상되고 네슬레와 함께 상업화 예정에 있습니다.

그럼 지금부터 SER-109에 대해 조금 더 자세히 설명하겠습니다


이 치료제는 C.difficile 감염증 치료제입니다. C.디피실 균이 장내에서 과잉 증식하면 설사와 염증을 유발하고 조금 더 심해지면 장기부전, 거기서 더 심해지면 사망까지 이르게 하는 그런 감염증인데 현재 이 감염증의 대표적인 치료방법은 항생제투여입니다.
그렇지만 항생제 치료 이후에도 C.디피실이 재발하기도 하고 무엇보다 문제는 예를 들어 항생제로 치료하게 되면 C.디피실균만 죽이는 게 아니라 이 C.디피실균을 억제하는 이로운 균도 같이 죽이게 되는데, 점차 C.디피실균이 득세하게 되면서 반복적으로 항생제를 투여하게 되면 재발 위험이 점점 커지게 되기 때문에 감염증에 대한 항생제 이후에 새로운 치료 전략이 필요합니다.
이렇게 재발하는 환자가 40~50%가 되고 악순환은 계속 이어지는데요. 미국에서 재발 CDI가 15만6천 케이스로 예상되고있고, 미국에서만 매년 2만명 이상이 CDI로 사망하고 있다고 합니다. 그래서 미국 CDC에서는 위협 레벨을 Urgent로 분류할 만큼 심각한 상황입니다.
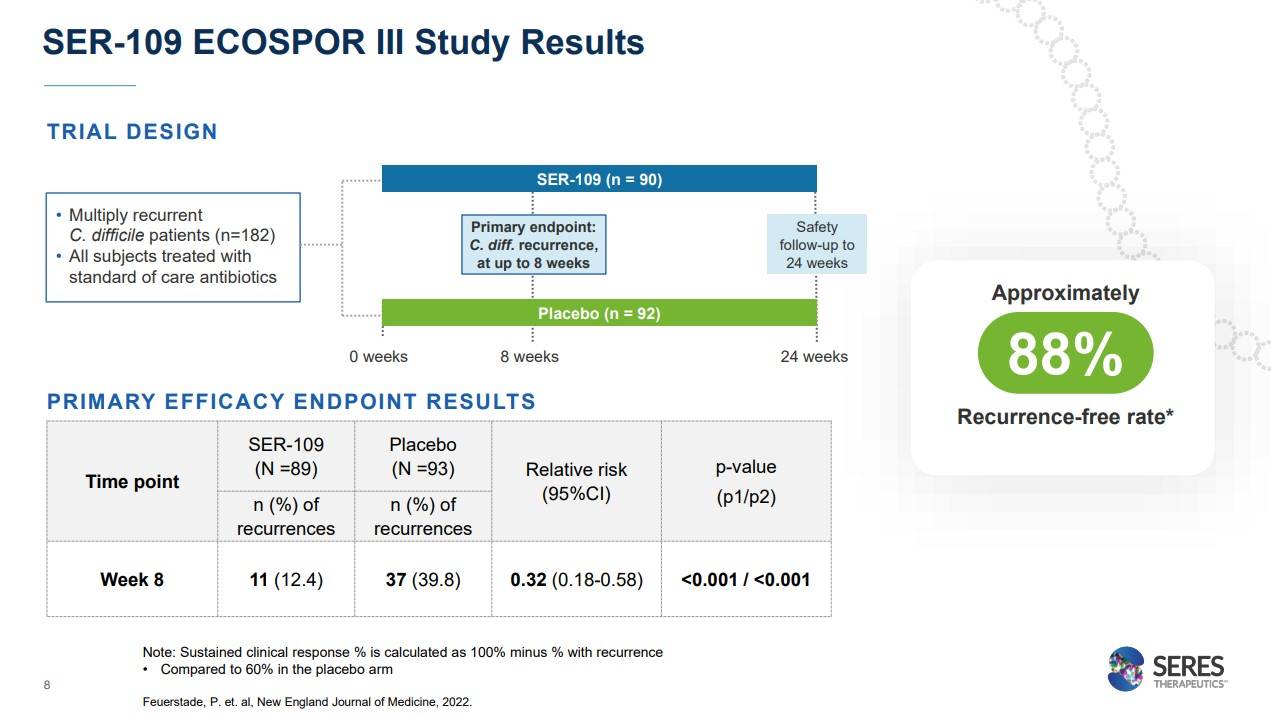
재발성 CDI에 있어서 SER-109의 3상 연구결과를 보면, SER-109군 90명, Placebo군 92명 총 182명으로 진행된 더블블라인드 임상을 24주간 진행했는데요.
primary endpoint (주요 연구종점)를 봤을때 8주시점에서 SER-109군에서 12.4%, placebo군에서 39.8%가 재발했하는 차이를 보였고, SER-109는플라시보에 비해 상대적 위험감소를 32% 줄여줬고, 양군의 차이는 p값이 0.001이하로 나오면서 임상을 성공했습니다.
또한 24주간 임상을 완료했을때, recurrence-free rate (재발 없는 비율)이 무려 88%가 나오면서 아주 좋은 결과를 입증한바 있습니다
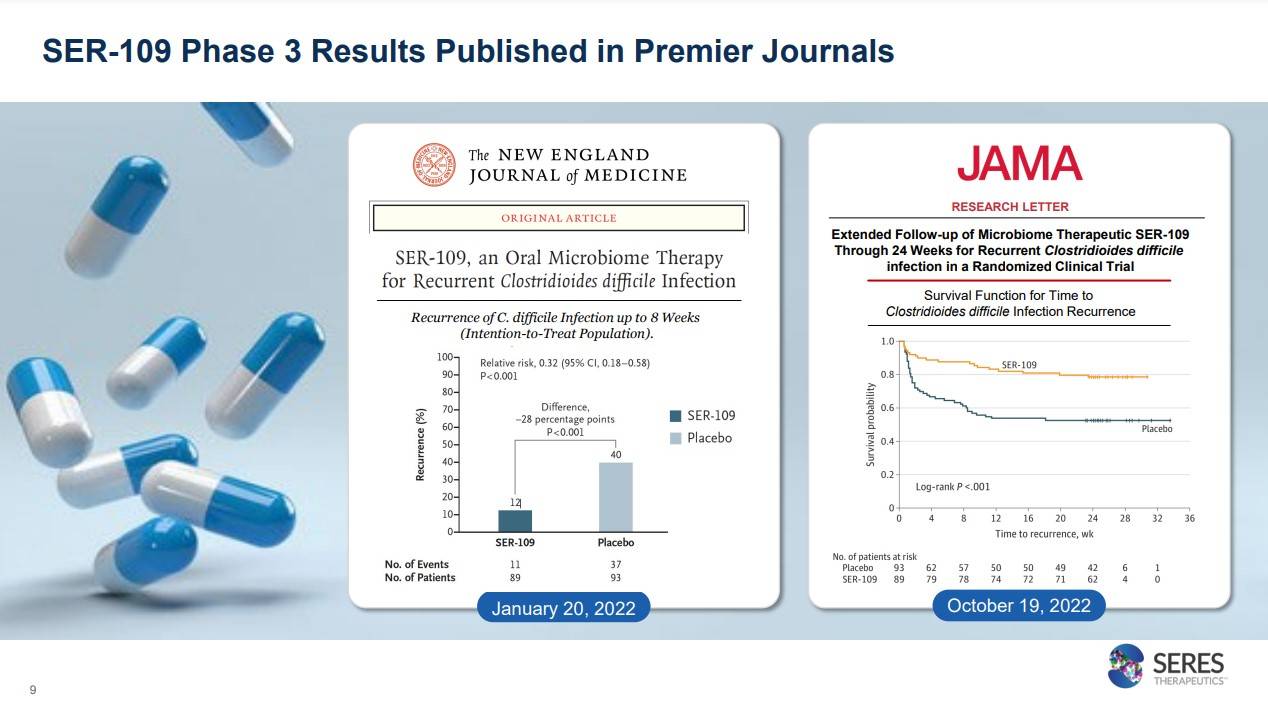
이러한 3상 결과가 세계 최고 저널 중 하나인 NEJM(impact factor : 176)과 JAMA(impact factor : 157.1)에 올라가는 성과를 보였습니다. 부연설명하면 NEJM은 위 3상 임상이, JAMA엔 24주간 연장스터디 내용이 실렸습니다

안전성 결과를 살펴보면, 두 군이 모두 유사하게 나왔고 안전하게 나왔습니다. SER-109군에서 사망사례가 나왔지만 약과는 관계없는 사망이었다고 합니다.
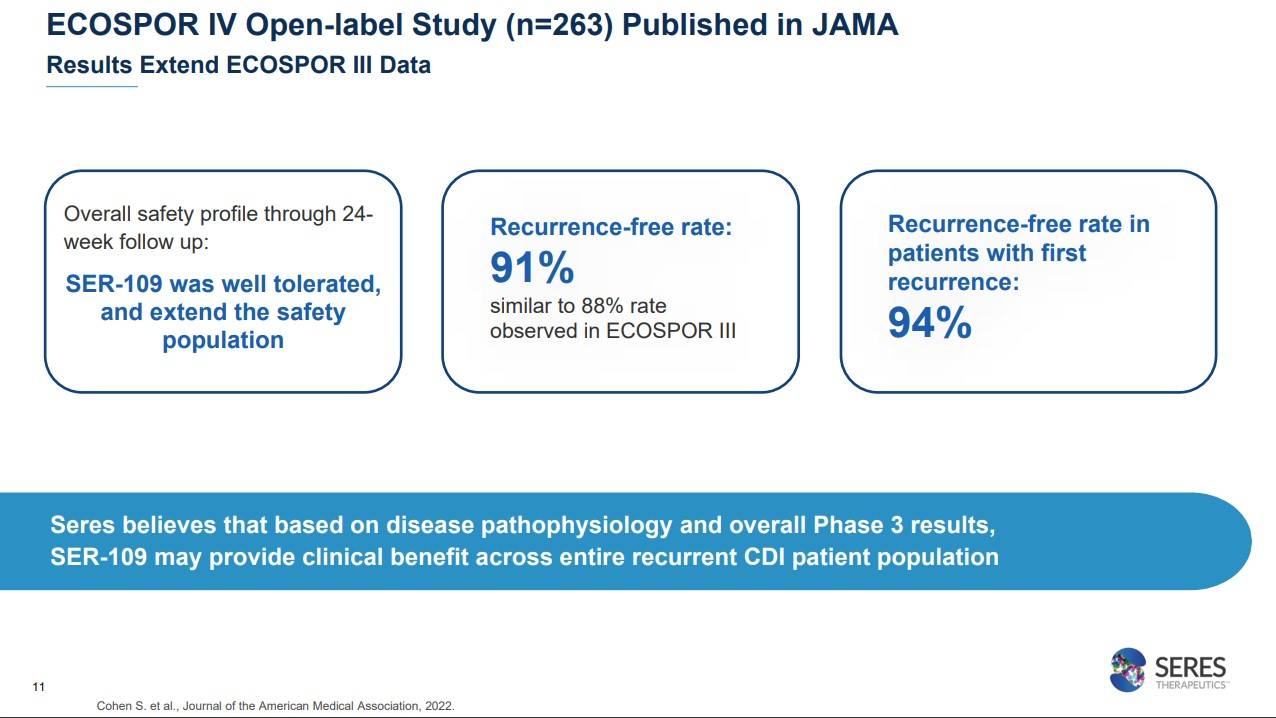
JAMA에 퍼블리시된 ECOSPOR 4 스터디(ECOSPOR 3 확장연구)는 263명을 대상으로 오픈라벨로 진행된 임상이었는데, 24주간 진행된 연구에서 안전했고, ECOSPOR 3 연구 (88%)와 유사한 91%의 재발프리율을 보였습니다.
Seres는 질병 병태생리학 및 전체 3상 결과를 기반으로 SER-109가 전체 재발성 CDI 환자 집단에 임상적 이점을 제공할 수 있다고 믿는다고 합니다.
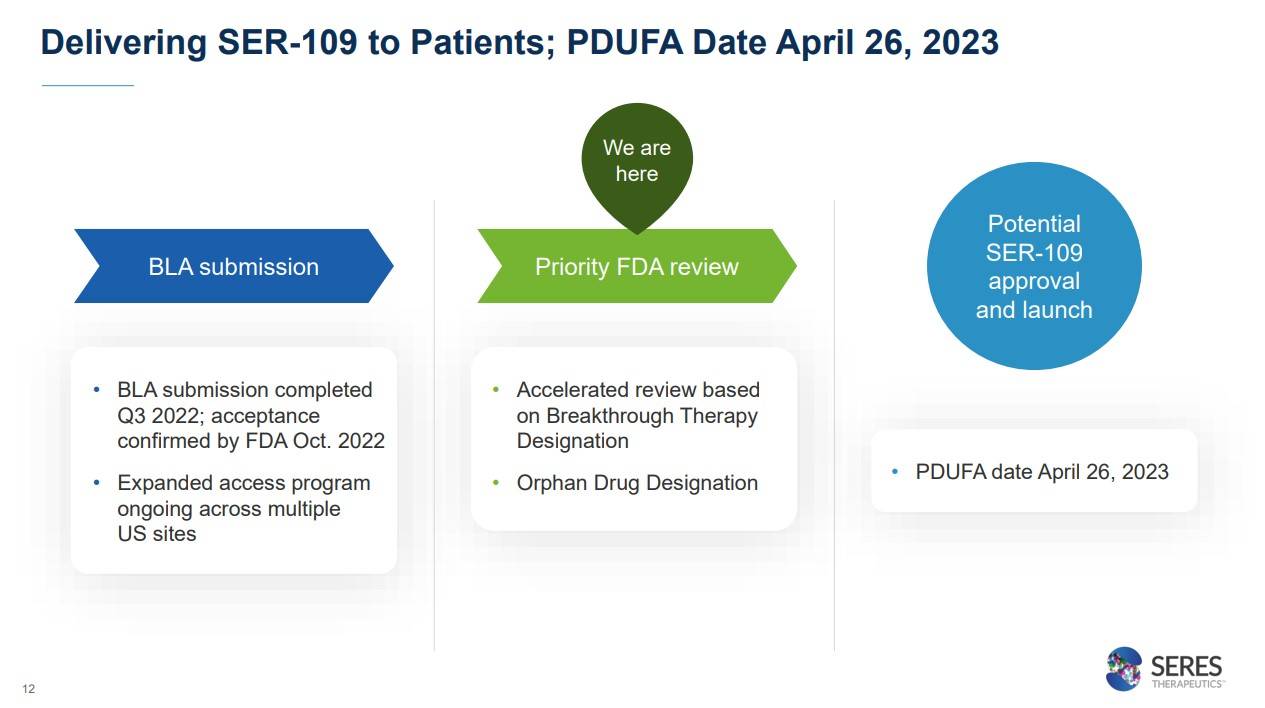
22년 3분기에 BLA제출을 완료했고, 현재 Breakthrough therapy 지정에 기초하여 accelerated review를 진행중에 있고, 4월 26일(미국시간)에 승인여부가 결정되는 상황입니다.
보통 FDA는 신약 개발 승인까지 통산 1년 정도 검토 기간을 가지는데, 신속심사 대상인 만큼 이 기간의 절반인 6개월이 걸려 이번 4월에 발표예정에 있습니다.

SER-109는 미충족요구를 충족시킬 수 있고, 재발 사이클에 조기에 사용하면 추가재발을 막을 수 있습니다
SER-109는 치료 알고리즘에서 고유한 위치를 차지할 수 있으며 잠재적으로 치료 표준을 변화시킬 수 있습니다.
승인되면 SER-109는 재발의 악순환에 빠진 광범위한 환자들에게 적절한 기초 치료법이 될 수 있다고 합니다.

2022년 12월기준 181.3M (대략 2400억원)의 현금이 있는 상태인데, FDA 승인시 네슬레로부터 125M(대략 1660억원)의 마일스톤을 받게 된다고 합니다. 현재 시총이 1조 800억 수준인데, 시총의 1/10 이상을 마일스톤 받게 되네요.
승인받게 된다면 충분한 주가 상승이 예상되는 부분입니다.
이런 이유 외에도, 이 회사의 승인여부가 관심이 집중되는 이유는 세레스의 SER-109가 경구용 마이크로바이옴 치료제의 최초승인이기 때문입니다. 새로운 역사가 되는 부분이죠.
기존에 페링제약에서 마이크로바이옴 치료제가 같은 질환에 대해 있습니다. 먼저 승인받았지만, 해당약은 항문으로 넣는 방식으로 불편함이 따르죠.
하지만 세레스는 캡슐화된 경구제형으로 만들어졌기 때문에, 실질적으로 보다 대중적으로 사용될수 있는 기반을 마련하게 되는 겁니다.
빌 게이츠가 마이크로바이옴을 세계를 바꿀 세가지 기술 중 하나로 꼽은 것은 장내미생물이 갖는 엄청난 포텐셜 때문이겠죠. 차후 마이크로바이옴으로 치매나 파킨슨, 그리고 항암제까지 적용분야가 말도 안되게 넓어질 것으로 예상됩니다
그런 기술을 상용화되기 위해선 보다 접근가능성이 높아야할 것입니다. 그런면에서 세레스 테라퓨틱스의 SER-109는 만약 승인을 받게 된다면, 세상에 마이크로바이옴치료제를 크게 진전시킨 대표적인 사례로 남게 될것으로 보여집니다.
해당 약 승인에따라 국내 마이크로바이옴주에도 영향이 있지않을까도 생각되고요. (지놈앤컴퍼니, 고바이오랩 등)
2023년 4월 26일(미국시간) 거의 임박했는데요. fda에서 어떤 결론을 낼지 지켜봅시다
Disclaimer
- 저자는 보고서 제공 시점 기준 일부 보유하고 있어 편향된 시각일 수 있습니다.
- 본 보고서는 오렌지 보드에 독점 기고합니다.
- 당사의 모든 콘텐츠는 저작권법의 보호를 받은바, 무단 전재, 복사, 배포 등을 금합니다.
- 콘텐츠에 수록된 내용은 개인적인 견해로서, 당사 및 크리에이터는 그 정확성이나 완전성을 보장할 수 없습니다. 따라서 어떠한 경우에도 본 콘텐츠는 고객의 투자 결과에 대한 법적 책임소재에 대한 증빙 자료로 사용될 수 없습니다.
- 모든 콘텐츠는 외부의 부당한 압력이나 간섭없이 크리에이터의 의견이 반영되었음을 밝힙니다.
Disclaimer
- 당사의 모든 콘텐츠는 저작권법의 보호를 받은바, 무단 전재, 복사, 배포 등을 금합니다.
- 콘텐츠에 수록된 내용은 개인적인 견해로서, 당사 및 크리에이터는 그 정확성이나 완전성을 보장할 수 없습니다. 따라서 어떠한 경우에도 본 콘텐츠는 고객의 투자 결과에 대한 법적 책임소재에 대한 증빙 자료로 사용될 수 없습니다.
- 모든 콘텐츠는 외부의 부당한 압력이나 간섭없이 크리에이터의 의견이 반영되었음을 밝힙니다.