|
※ 감수인 의견 좋은 투자 아이디어 공유해 주셔서 감사 드립니다. 바이오는 기대감으로 주가가 움직이는 특성이 있어, 시장에 대한 조사가 충분해야 겠습니다(시장의 크기가 현재 시가총액을 설명하기에 충분해야 함).
시총/주가 (내부자 지분율 40%) 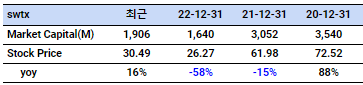
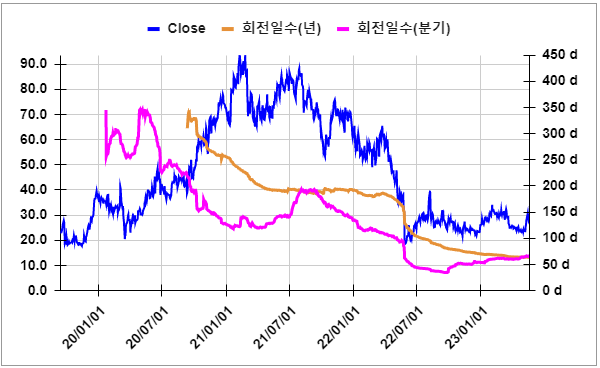
용어 PDUFA (Prescription Drug User Fee Act) date는 미국 식품의약국(FDA)이 신약 승인 신청(NDA, New Drug Application) 또는 생물학적 제품 승인 신청(BLA, Biologics License Application)에 대한 결정을 내리는 예정일을 의미합니다. PDUFA는 1992년에 미국 의회에서 제정되어 FDA의 신약 승인 과정을 가속화하기 위해 도입된 법률입니다. 스핀오프(Spin-off)는 기업이 자사의 특정 부문이나 자회사를 분리하여 새로운 독립적인 회사를 설립하는 것을 말합니다. 이렇게 스핀오프된 회사는 원래의 모회사로부터 자금, 자산, 인력, 기술 등을 받아 운영하게 됩니다. 이환율(Morbidity rate) : 집단에서 일정 기간 동안 관찰한 환자의 수를 백분율 한 것 데스모이드 종양(desmoid tumor)은 매우 드문 비암성 연조직 종양으로, 연조직은 근육이나 신경을 연결하고 지원하는 역할을 합니다. 이 종양은 세포들이 조직의 특정 부분에 과도하게 증식하면서 발생합니다. 데스모이드 종양은 암과 달리 전이하지 않지만, 그 성장은 때때로 골격, 신경, 혈관 또는 내장기관과 같은 중요한 구조를 침범할 수 있어 문제가 될 수 있습니다. 이로 인해 심각한 합병증을 유발할 수 있으며, 경우에 따라 수명을 단축시킬 수 있습니다. 암 치료의 부작용은 "등급" 으로 분류되어 그 심각성을 평가합니다. Grade 1: 경미한 증상; 치과 치료나 통증제가 필요하지 않은 경우.
요약
*앱을 설치하시면, 구독하시는 크리에이터에 대한 새글 알림을 받아보실 수 있습니다. '오렌지보드' 로 검색하셔서 설치 부탁 드립니다. Orangeboard.CT가 작성한 글에 댓글로 피드백 주시면, 고객 본인이 원하는 기능이 적용될 수 있습니다. 참여 부탁 드립니다. |
안녕하세요 필사즉생입니다
오늘 분석할 회사는 스프링웍스 테라퓨틱스 (Springworks Therapeutics)입니다. 한국에도 무수히 많은 소형 바이오텍이 있지만, 미국에서도 셀 수없을만큼 많은 바이오회사가 있습니다. 이 많은 회사에 대한 정보도 한국에서 얻기도 제한적이고, 좋은 회사이지만 상대적으로 덜 알려져있는 숨은 진주 또한 많은 것 같습니다.
하지만 흙속에서 진주찾기가 어렵긴하고, 바이오종목 특성상 high risk high return이다보니, 항상 유념해야할 부분이기도 합니다. 전 주로 신약승인결정을 해야하는 PDUFA 날짜가 잡힌 회사 위주로 소개하고 있습니다.

오늘 소개할 스프링웍스 테라퓨틱스는 다소 생소하게 여겨질수도 있지만, 외국에서는 나름 알려진 바이오텍입니다. 현재 시가총액도 2조4천억원이 될 정도로, 이제까지 제가 쓴 여러 회사들에 비해 높은 시가총액을 가지고 있기도 합니다.
스프링웍스는 우리가 너무나 잘 알고있는 글로벌제약회사 화이자에서 스핀오프한 회사입니다. 투자금은 외부투자를 끌여들여 6천억원의 펀딩을 이끌어냈습니다. 화이자의 후기 항암 파이프라인을 라이센싱해와서 개발하고 있는데, 희귀항암환자를 위한 항암신약을 개발하려는 목적으로 설립되었습니다.

슬라이드에서부터 이 회사의 자신감을 볼수 있을 것 같습니다. 이 글의 소제목을 여기서 따왔는데요. 표적항암자의 full 포텐셜이 잠금해제 대기중이라고 하네요. 정말로 장금해제되어 신약으로 성공할지는 앞으로 지켜봐야겠지만요.
현재까지는 후기임상개발 회사였지만, 올해 하반기에는 커머셜 스테이지의 회사가 되려고 합니다. 다양한 후기 임상파이프라인을 가지고 있고 2025년까지 2개의 항암제를 승인받으려고 하고 있는데요. 가장 먼저 오늘 다룰 Nirogacestat이 데스모이드 종양에 대해 승인심사 중입니다.
IP는 미국에서 2040년도 이후까지 길게 보호되고 있고, 528m달러 (약 7천억원)의 현금을 보유하고 있다고 합니다
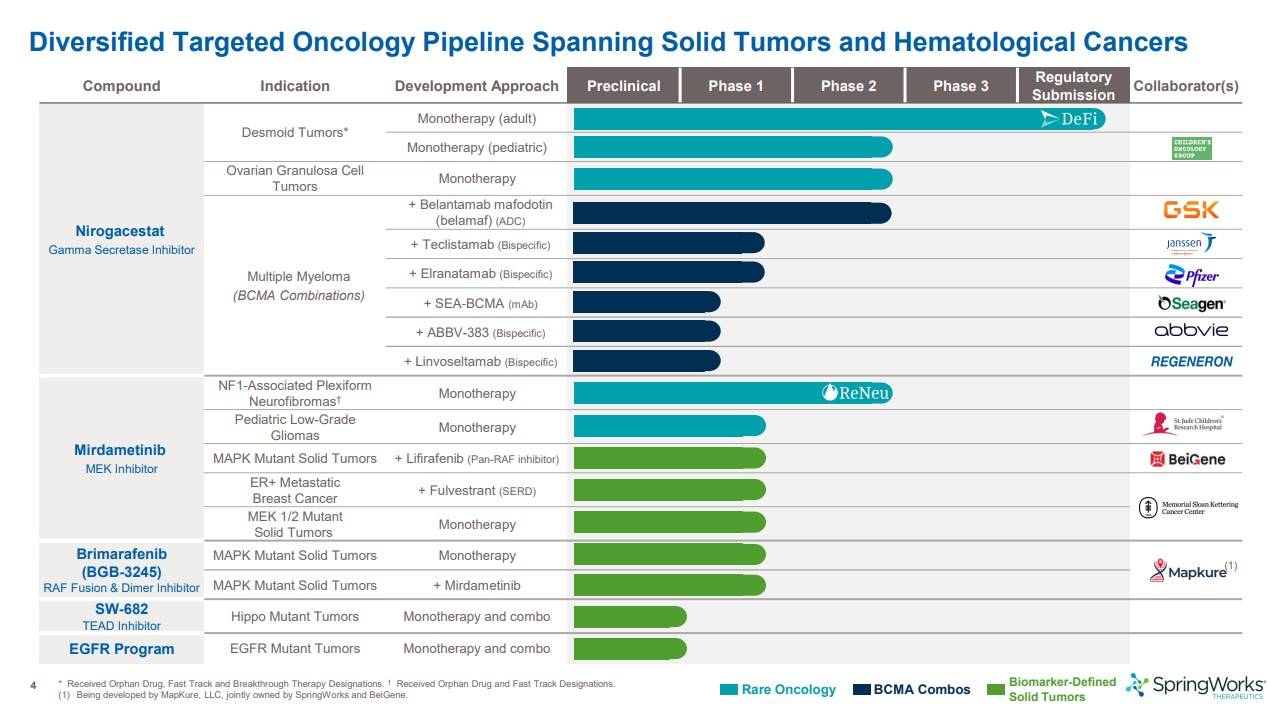
현재 임상단계에 진입한 파이프라인이 많은데, 그 중에서도 대표적인 2가지 물질은 gamma secretase inhibitor인 Nirogacestat과 MEK저해제인 Miradametinib 입니다. 이 두가지 물질을 기반으로 다양한 암종으로 임상을 진행중이고, 여러 회사와 병용임상 진행도 굉장히 활발히 진행중입니다
특히 Multiple Myeloma (다발성 골수종)을 타겟으로 GSK, 얀센, PFIZER, abbvie 등 굴지의 회사와 병용임상진행중에 있습니다.
현재 스프링웍스 단독으로는 Nirogacestat 으로 데스모이드 종양이 가장 앞선 단계를 밟고 있습니다.

현재 데스모이드 종양을 타겟으로 하는 Nirocacestat은 3상임상을 성공적으로 마무리하고, NDA진행중이며, 2023년 8월 27일이 PDUFA날짜입니다. 이 3상 결과는 세계최고의 저널인 NEJM에 퍼블리시되었습니다.
추가적인 Defi 스터디 분석내용은 2023년 ASCO에서 발표할 예정이라고 합니다. 만약 승인된다면 데스모이드 종양환자에 있어서 첫번째로 FDA승인되는 약물입니다.
ovarian granulosa cell tumor(난소과립막세포종양)으로는 현재 2상 진행중에 있습니다. 그리고 Mirdametinib의 2b상 결과도 올해 하반기중 탑라인 발표될 예정이라고 하네요

Nirogacestat 은 선택적인 gamma secretase inhibitor(GSI)의 작용기전을 가지고 있는데요. GSI는 새로운 단백질 생성에 관여하는 효소인데, GSI를 억제해서 암세포 분열을 촉진하는 세포막 단백질의 분비를 막는 방식입니다.
NDA 진행하면서 fda로부터 Priority review (우선심사대상)로 지정받았습니다. Priority review는 심각한 질환을 치료하고 안전성이나 효과를 상당히 개선시키는 의약품에 부여하여 심사기간을 줄여주는데요. fda는 자문위를 열 계획이 없다고 밝혔습니다. 자문위가 열리지 않는 것을 보면, 효과와 안전성에 대해서는 이견이 없다고 추측할 수 있을 것 같습니다.
3상 Defi 스터디에서 주지표를 포함하여 모든 2차지표도 성공한 결과를 보였습니다. 자세한 임상결과는 다시 언급하겠습니다

데스모이드 종양에 대해서 좀 더 알아볼 필요가 있는데요
데스모이드 종양은 몸 전체에서 생길수 있고, 삶을 변화시키는 중대한 이환율을 보이는데요. 다발성으로 생기기도하고, 환자들은 상당한 통증을 느끼거나 상당한 신체적 제한을 겪는다고 합니다
종양으로 인해 심각한 궤양이 생기거나 장기 기능 장애가 발생할수 있고, 이로 인해 심각한 경우 사망에 이르기까지 합니다.
데스모이드 종양은 주로 soft tissue에 발생하며 전이는 되지않지만, 상당히 환자의 삶의 질을 파괴하는 종양입니다. 현재 승인된 치료법은 없는 상황이고요. 그래서 주로 화학치료, 방사선 치료 등을 하고 있고, 수술로 절제하기도 하는데, 수술을 하더라도 77%가 재발되기도 한다고 하네요

3상 임상 디자인인데요. 북미와 유럽에서 진행한 더블블라인드 임상이고 142명의 환자로 진행되었습니다. Nirogacestat 150mg을 bid(하루2번 복용)로 복용한 군과 placebo 군으로 나누어 진행했고, 추후 open-label로 확장연구를 수행하였습니다
주지표는 PFS (무진행 생존)을 보았고, 2차지표로 안전성과 내약성, ORR(objective response rate : 객관적 반응율) 과 MRI로 측정한 종양의 크기 등을 보았습니다.
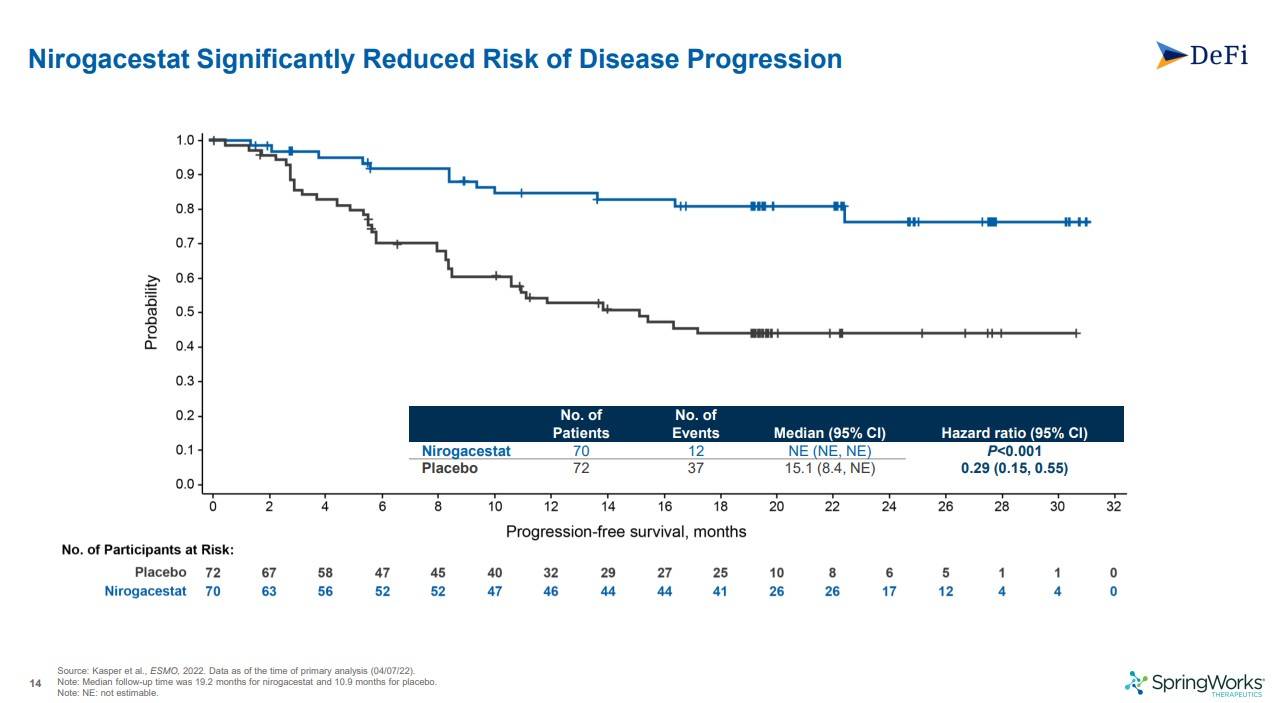
Nirogacestat은 플라시보와 비교하여 질별진행의 리스크를 확연하게 줄여주는 결과를 입증하였고 p값도 0.001이하로 유의하게 나와 주지표를 달성하였습니다.
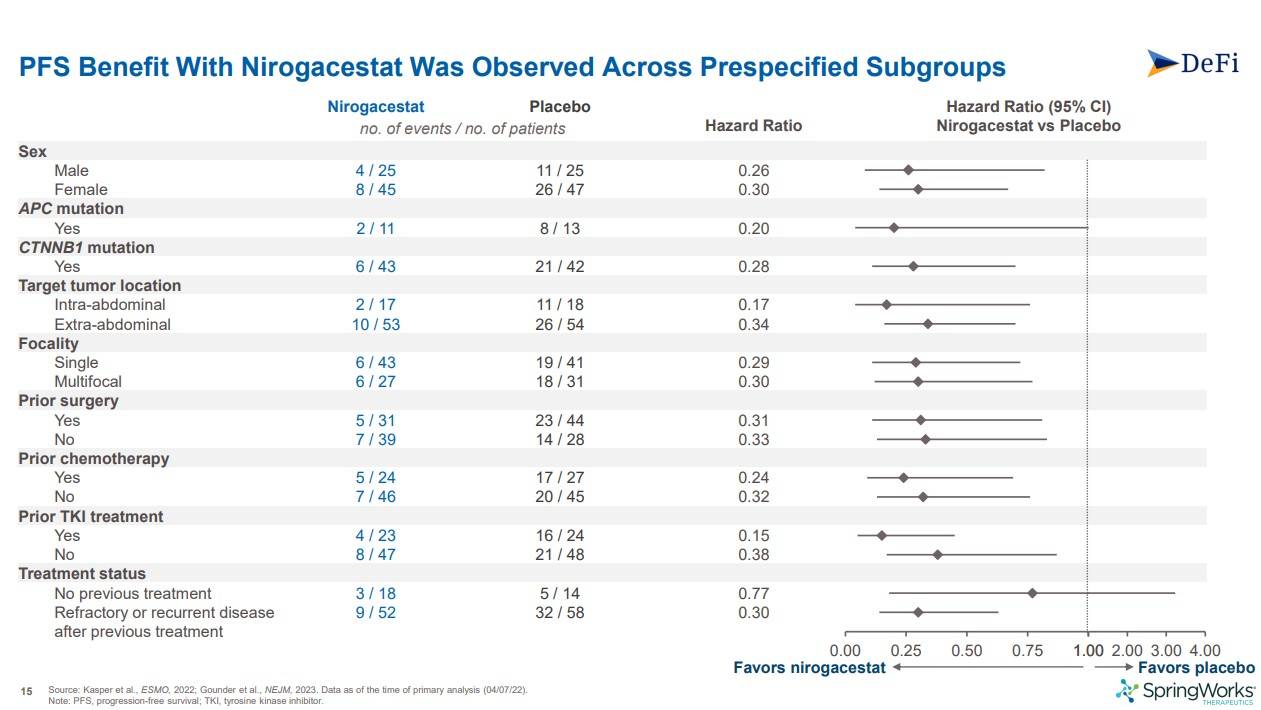
서브그룹 분석으로 pfs를 보니, 다양한 서브그룹으로 묶어도, Nirogacestat이 placebo에 비해 더 우월하게 나왔습니다. 우측 그래프를 보면, 모두 nirogacestat favor쪽으로 치우쳐져 있는 것을 알수 있었습니다
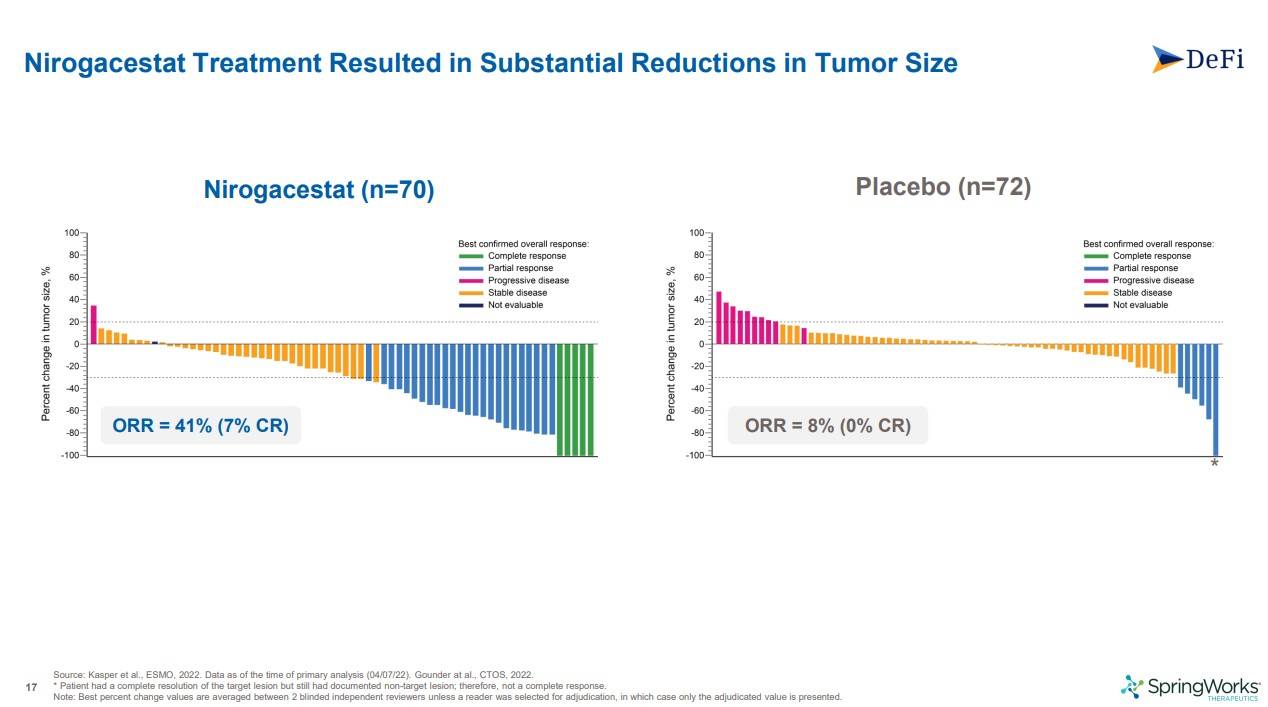
MRI를 통해 종양의 크기를 비교하였는데, Nirogacestat쪽에서 확연한 감소가 있었고, ORR(객관적반응율)이 41%, CR(완전관해)가 7%로 나온데 반해 플라시보쪽은 ORR이 8%, CR이 0% 였습니다.

주지표와 2차지표(통증지표, 종양크기, 삶의 질 등) 모두 P값이 0.05이하로 나오며 플라시보에 비해 유의한 효과를 입증했습니다.
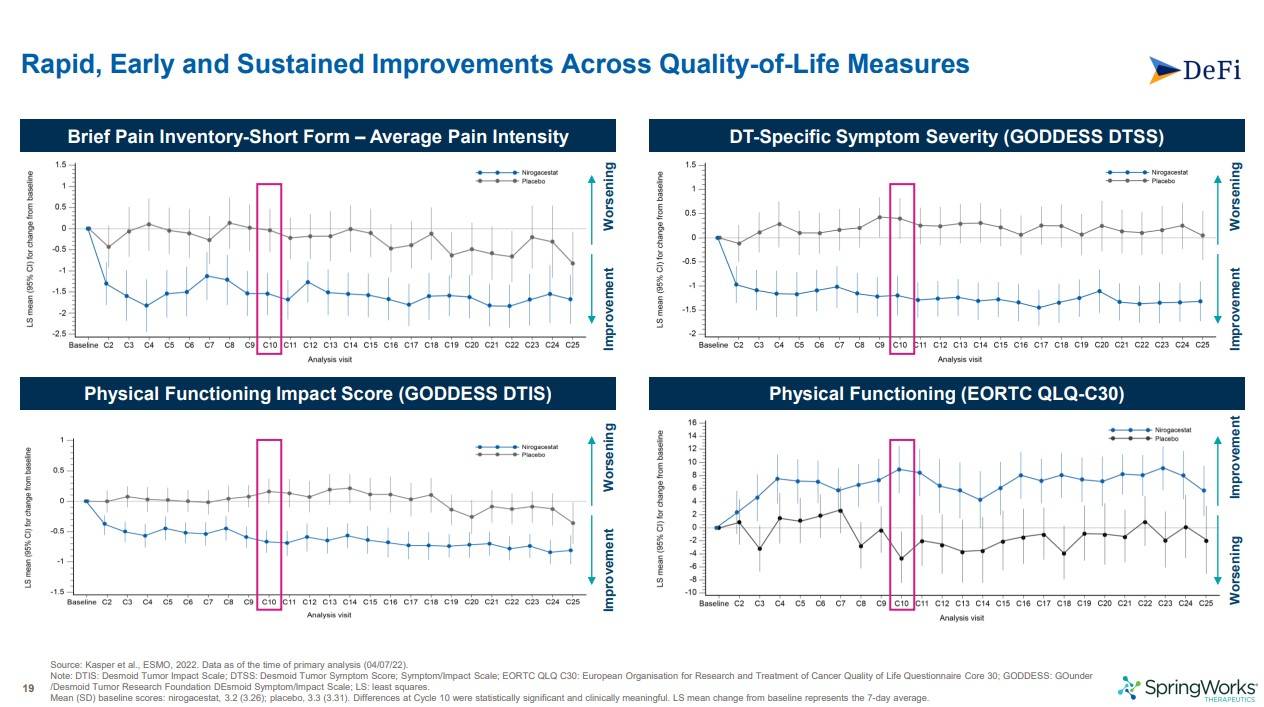
위 그래프는 0을 기준으로 아래쪽으로 갈수록 개선, 위로 갈수록 악화가 되는 것(Physical functioning은 반대)인데, 각 2차지표 그래프를 보면, 파란색의 nirogacestat쪽이 플라시보에 비해 훨씬 개선되는 것을 알수 있었고, 10번째 사이클에서 임상적으로 유의미한 차이(CID)가 나는 것을 보니 개선의 속도도 빠르단 것을 알수 있습니다.
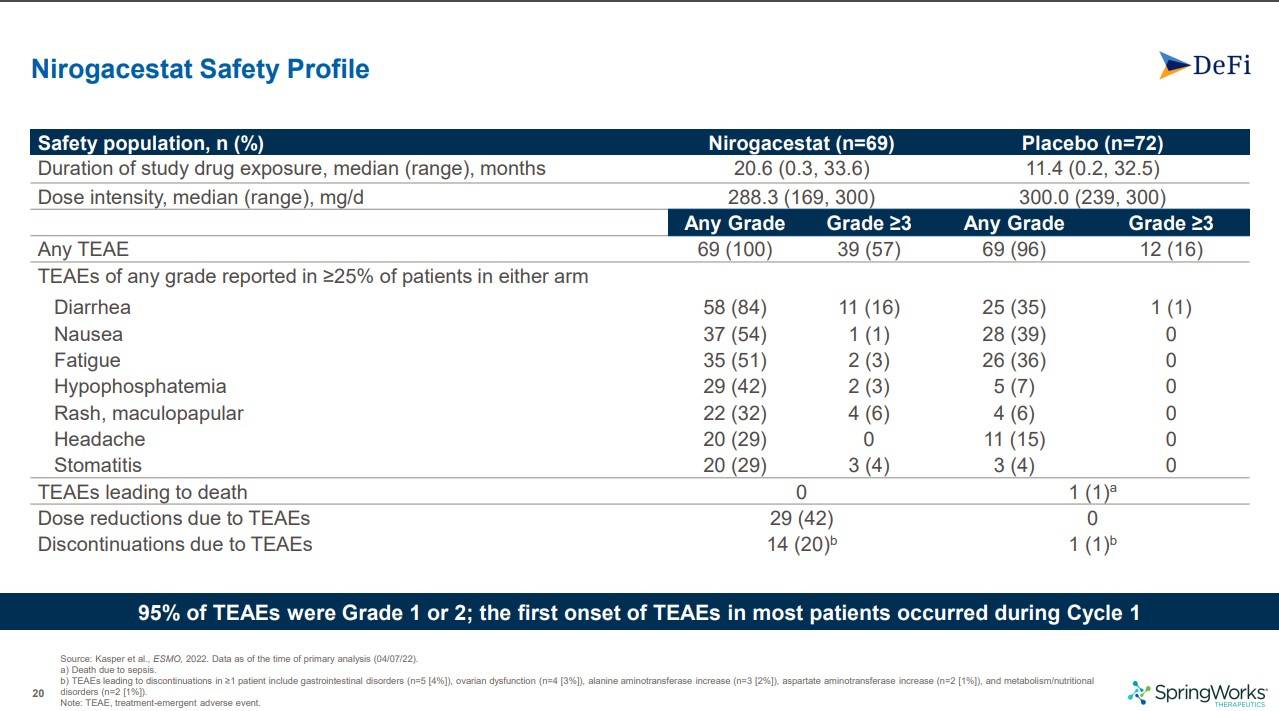
안전성 지표는 확실히 placebo에 비해서 nirogacestat쪽에서 많았는데, grade 1과 2정도의 부작용의 95%는 대부분 첫번째 사이클에서 발생했다고 하고, grade 3이상의 부작용은 nirogacestat에서 57%, placebo에서 16%가 나왔습니다.
부작용으로 인한 약물 도즈를 줄인 경우는 42% vs 0%, 약물을 중단한 경우는 20% vs 1%로 nirogacestat이 확연히 높게 나왔습니다
아무래도 종양을 치료하는 항암제다보니 부작용비율이 적진 않네요. 하지만 앞서 언급했듯 따로 자문위원회도 열지않는 것으로 보아, 안전성에 대한 특별한 이슈는 없는 것으로 보여집니다
이제까지 3상결과에 대해 알아보았고 이게 시장성이 있는지 살펴보면

매년 1000~1650명의 환자가 진단이 되고, 매년 5500~7000명의 환자가 치료를 받고 있는데. 이건 전체 유병환자들의 20~25%만 치료를 받고 있다고 합니다. 재발율이 매우 높지만 오프라벨로 치료받고 있는데 내약성이 매우 떨어지는 실정이라 새로운 치료법이 나온다면, 상당히 많은 환자들이 베네핏을 얻을 거라 생각됩니다
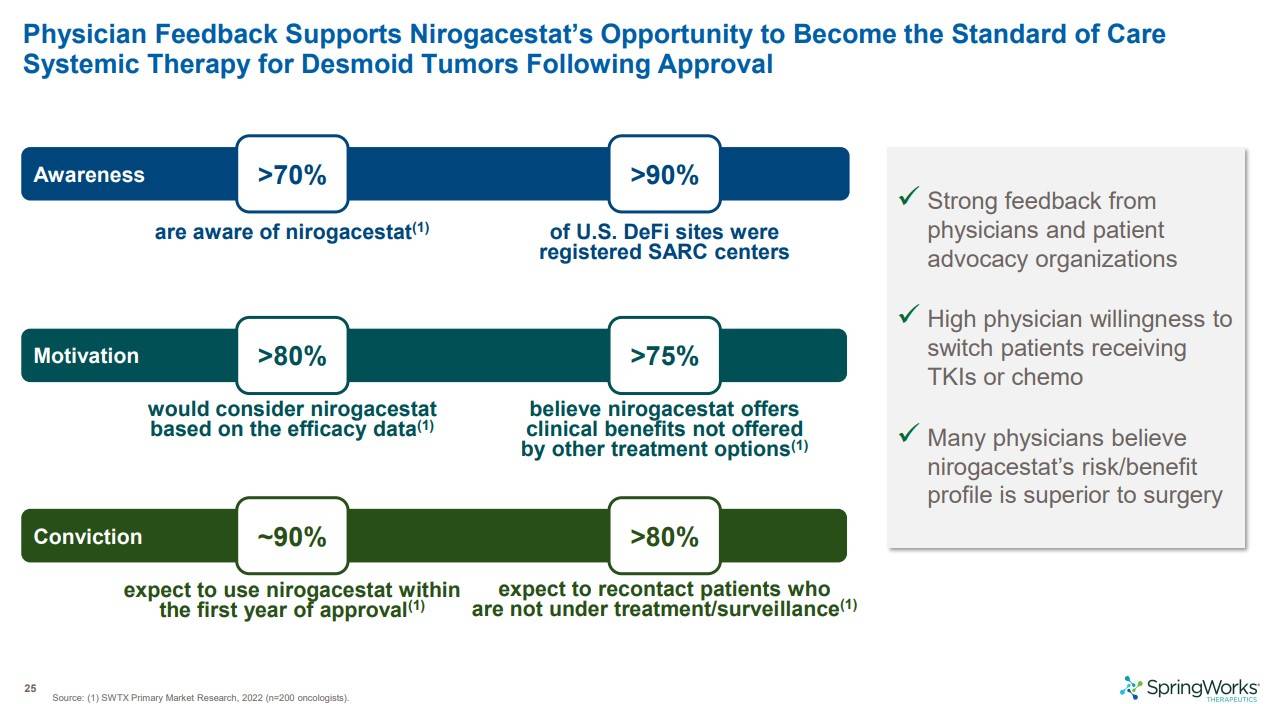
무엇보다 약이 나온다면 의사들이 많이 써야하는데, 사전 서베이 결과를 보면 Nirogacestat에 대한 의사들의 큰 기대를 볼수 있습니다. 의사들의 70%이상이 인지하고 있으며, 효과적인 데이터를 기초하여 nirogacestat의 사용을 고려하는 의사가 80%이상, 기존의 다른 치료옵션보다 nirogacestat이 주는 베네핏이 더 크다고 믿는 의사가 75%이상이나 됩니다.
승인후 첫해안에 Nirogacastat을 사용할거라는 의사가 90%이상이라는 결과까지 보일정도로, 의사들에게도 큰 기대를 갖게하는 약입니다
현재 시가총액은 앞거 언급한대로 2조4천억원 대라, 아직 승인된 약이 없는 바이오텍 치고는 적은 시총은 아닙니다. (고점에서 반토막이상 빠진 상황이기도 함) 하지만 여러 약들이 글로벌 빅팜들과 협업중이고, 단독으로 사용될 신약도 승인과정을 밟고 있어, 향후 장기적으로는 주가상승을 기대할 만 합니다
물론 여러 케이스에서 확인되었듯, 승인이 되더라도 조정이 있을 수 있고, 제조 등 서류문제로 중간에 승인거절이나 반려될수도 있는 리스크는 있지만, 화이자에서 라이센싱한 약을 바탕으로 희귀항암제를 개발하는 회사로서 장기적으로 상당히 기대가 되는 회사이기도 합니다.
Disclaimer
- 저자는 보고서 제공 시점 기준 일부 보유하고 있어 편향된 시각일 수 있습니다.
- 본 보고서는 오렌지 보드에 독점 기고합니다.
- 당사의 모든 콘텐츠는 저작권법의 보호를 받은바, 무단 전재, 복사, 배포 등을 금합니다.
- 콘텐츠에 수록된 내용은 개인적인 견해로서, 당사 및 크리에이터는 그 정확성이나 완전성을 보장할 수 없습니다. 따라서 어떠한 경우에도 본 콘텐츠는 고객의 투자 결과에 대한 법적 책임소재에 대한 증빙 자료로 사용될 수 없습니다.
- 모든 콘텐츠는 외부의 부당한 압력이나 간섭없이 크리에이터의 의견이 반영되었음을 밝힙니다.

Disclaimer
- 당사의 모든 콘텐츠는 저작권법의 보호를 받은바, 무단 전재, 복사, 배포 등을 금합니다.
- 콘텐츠에 수록된 내용은 개인적인 견해로서, 당사 및 크리에이터는 그 정확성이나 완전성을 보장할 수 없습니다. 따라서 어떠한 경우에도 본 콘텐츠는 고객의 투자 결과에 대한 법적 책임소재에 대한 증빙 자료로 사용될 수 없습니다.
- 모든 콘텐츠는 외부의 부당한 압력이나 간섭없이 크리에이터의 의견이 반영되었음을 밝힙니다.