부산v2스터디의 팜
알테오젠(196170)

V2
2025.08.08
## 핵심 요약(Executive Summary)
- 2019년~현재까지 ALT-B4 기술이전 누적 계약규모 US $7,455M(약 10조 3500억원) + α(산도즈 계약규모 비공개)
- 글로벌 매출 1위 의약품 ‘키트루다(Keytruda)’ SC제형 2025년 10월 1일 출시 예정
- 글로벌 1위 ADC ‘엔허투’ 개발사 다이이찌 산쿄, 아스트라제네카(메드이뮨) 등이 동사의 기술을 선택하며 항체의약품뿐만 아니라 ADC, 이중항체 등으로 적용 범위 확대 중
- 동사는 매년 2건 이상의 ALT-B4 신규 계약 체결 목표이며 현재 MTA 체결 9~10건
- 2019년 계약한 1차 계약사(사노피 추정) 연내 임상 1상 개시 및 기업 공개 예정
- 기존 경쟁사(할로자임)의 계약사(BMS 추정)도 L/O 접촉
- 엔허투SC 임상 1상 결과 확인 시, 계약 확대 및 타 ADC 기업의 SC 기술이전 가속화 기대
- 빠르면 올해 데이터 확인 및 내년 3상 진입도 가능해 엔허투SC 출시 시점은 2030년보다 당겨질 수 있음
- 2024년말 예상한 2025년 2건의 L/O 중 아스트라제네카는 계약체결되었고, 나머지 1건은 ADC 항암제 개발중인 화이자, 애브비, 길리어드 등이 유력 (하반기 중 1~2건 예상)
- 산도즈 다잘렉스SC 및 오크레부스SC 바이오시밀러 개발 공식화
- 현재 코스닥 시총 1위로 코스피 이전 시 패시브 자금 유입 기대
## 사업 내용(Business Model)
주요 파이프라인으로 ▲정맥주사(iv)를 피하주사(sc)로 전환해주는 하이브로자임(Hybrozyme™) ▲지속형 인성장호르몬 치료제(ALT-P1) ▲아일리아 바이오시밀러(ALT-L9) ▲허셉틴 바이오시밀러(ALT-L2) ▲히알루로니다제 단독제품 테르가제(ALT-BB4) 등이 있음
이 중 핵심인 하이브로자임(Hybrozyme™) 플랫폼 기술만 본 자료에서 분석함
### 핵심 기술 '하이브로자임(Hybrozyme™) 플랫폼'
알테오젠은 인간 유래 히알루로니다제(PH20) 유전자를 기반으로 하되, 면역원성 저감, 효소 안정성 향상, 구조적 개선 등을 위해 유전자 재설계를 수행하는 단백질공학 기술을 고유 브랜드명으로 '하이브로자임 플랫폼'이라고 정의함
PH20은 인간에 존재하는 6종(Hyal-1~4, PH20, HYALP1)의 히알루로니다제 중 하나로 효소 단백질임
이 효소는 히알루론산(Hyaluronic acid, HA)을 분해하는 역할을 수행함
피하지방층에는 고분자물질인 Hyaluronan이 있어 피부 조직을 지탱해 주고 있는데, 이 구조물 때문에 약물이 혈액으로 바로 흡수되지 못하고 피하에 저류하게 됨
#### 유전자 재조합 인간 히알루로니다제 'ALT-B4'
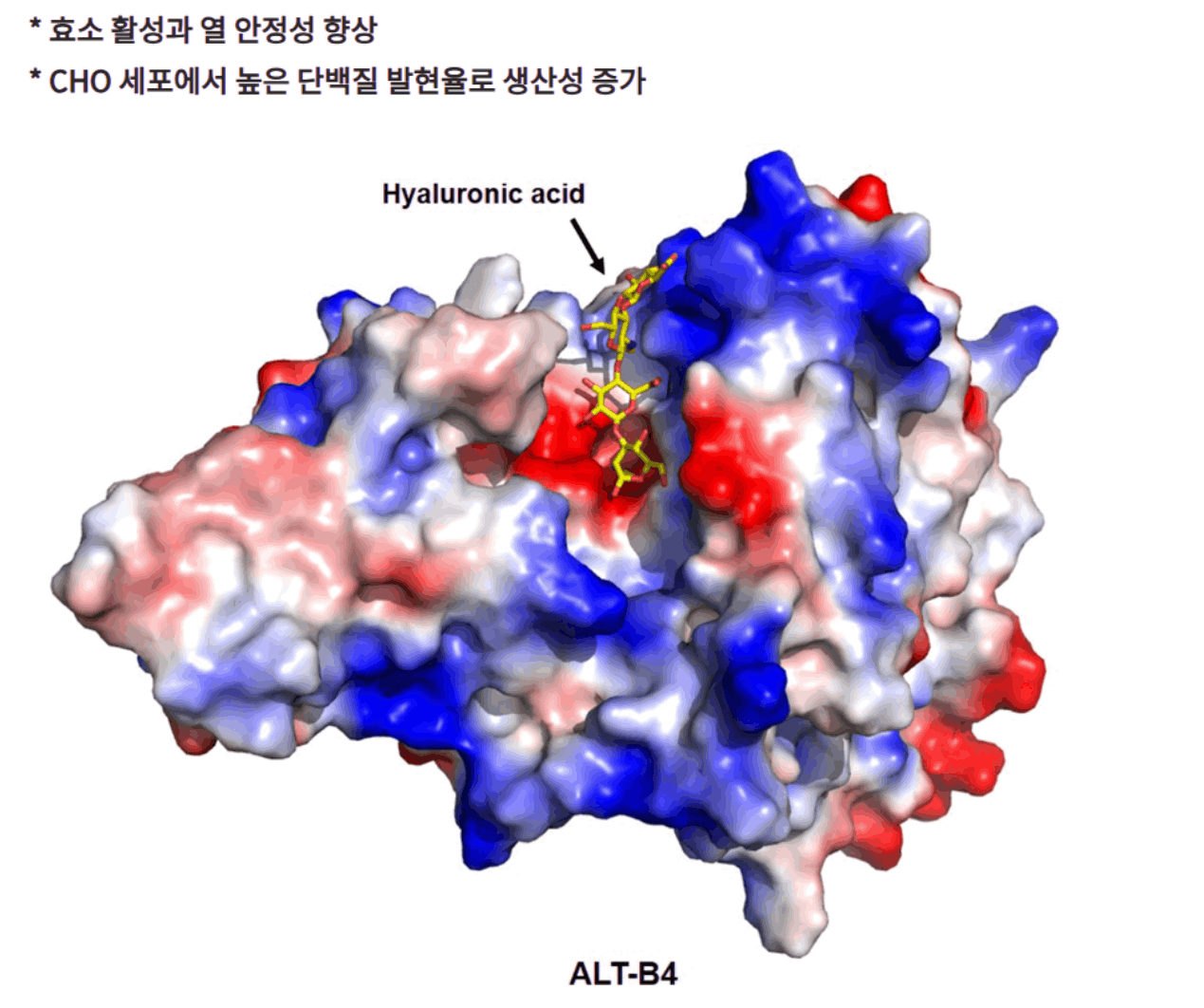
동사는 homology 모델링을 통해 PH20의 2차 구조를 유지하는 도메인을 규명한 후 각 도메인을 Hyal-1~4의 도메인과 교환(스와핑)한 변이체를 만들었음
개발 과정에서 300여개 이상의 PH20 변이체를 설계해 제조했고, 각 변이체를 발현시켜 정제한 후 효소의 활성과 열 안정성을 측정한 뒤 최종적으로 ALT-B4를 완성함
ALT-B4는 유전자 재조합 인간 히알루로니다제(recombinant human hyaluronidase, rHuPH20)로 기존 정맥주사(IV) 제형에 혼합하여 고용량 단백질·항체 약물을 피하주사(SC) 제형으로 변환시켜주는 동사의 핵심 원천 기술임
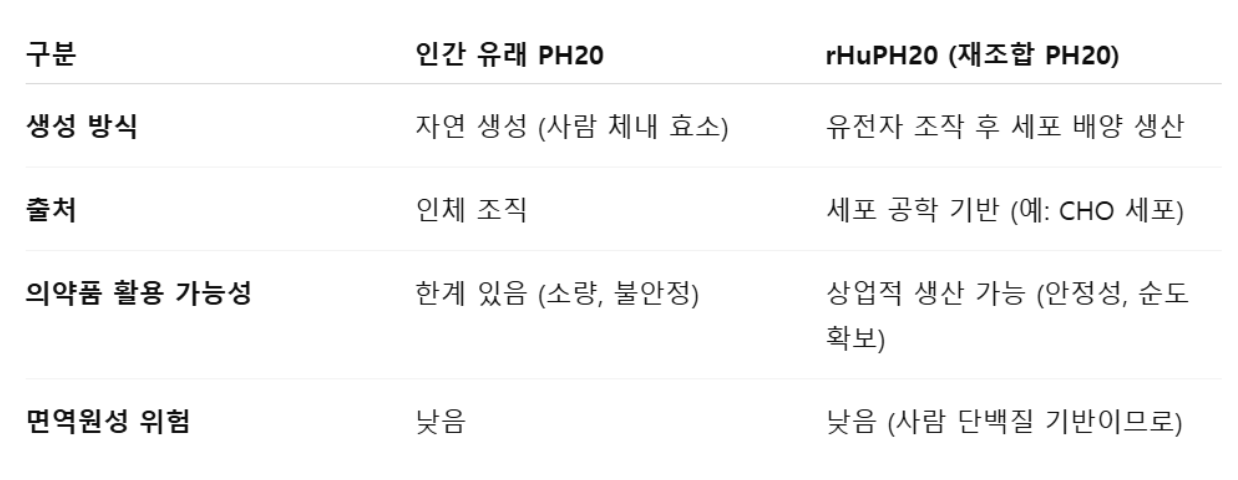
#### SC제형이 왜 필요한가?
정맥주사(IV)는 숙련된 의료진에 의해 혈관에 약물을 주입해야 하는 만큼 매번 환자들의 병원 방문이 필수적이기 때문에 의료 비용이 높아지고, 치료에 따라 수십분에서 수시간 동안 천천히 투여해야 하므로 환자 투약 편의성이 낮다는 단점이 있음
정맥주사를 피하주사로 전환하였을 때 의료진, 환자, 제약사 각각의 입장에서 얻는 이득을 보면,
- (의료진 입장)
- 약물 조제시간 단축하고 입원이 불필요해 환자의 병상을 더 많이 확보 → 의료기관 수익률 증대
- 특히 지역 병원의 경우 피하주사를 투여했을 때 생산성 손실과 비용을 절감
- (환자 입장)
- 정맥이 손상된 항암치료 환자들이 많아 피하주사를 투약할 경우 약물 투약의 접근성 개선
- 혈관주사와 동일한 약가로 책정되어 환자는 최종적 비용이 감소 → 치료비 부담 감소
- (제약사 입장)
- 특허만료를 앞둔 블록버스터 제품에 SC제형을 적용하여 시장에 먼저 출시해 IV제형의 바이오시밀러 진입 방어
- IRA 약가인하 회피
### 항체의약품 시장 규모 및 성장성
#### (1) 단일클론 항체 (Monoclonal antibody)
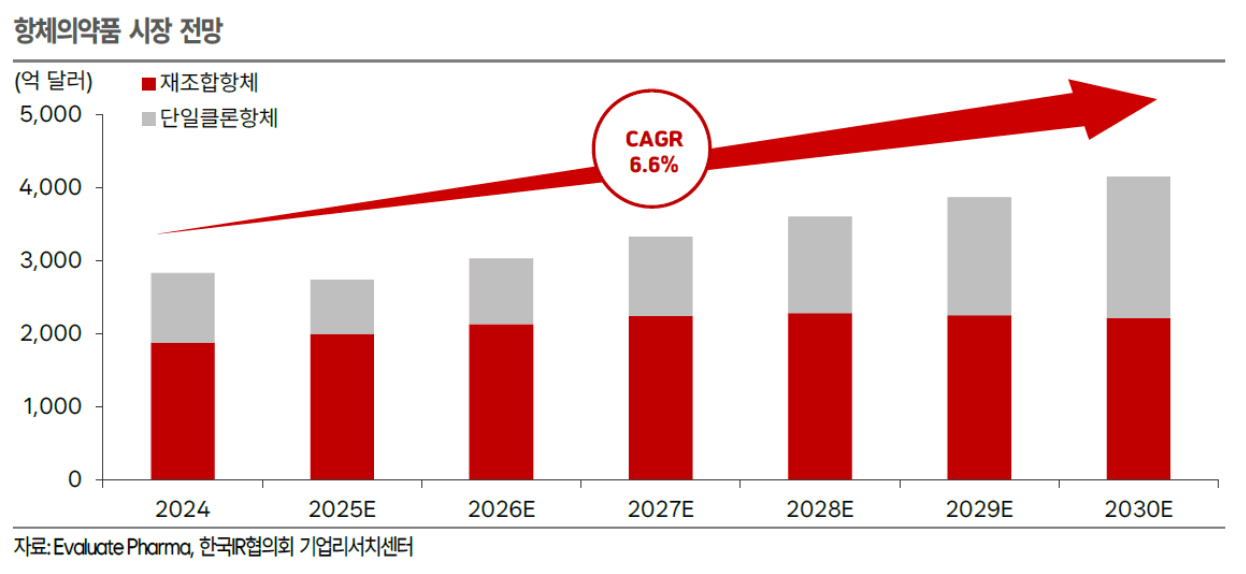
의약품 시장 조사기관 Evaluate Pharma에 따르면,
글로벌 항체의약품(재조합 항체 포함) 시장은 2024년 2,828억 달러(390조 1791억 원) → 2030년 4,149억 달러(572조 4375억 원) (CAGR 6.6%)
2024년 글로벌 매출액 상위 10개 의약품 중 단일클론 항체의약품이 절반을 차지했으며, 합산 매출액은 773억 달러를 기록
특히 면역관문억제제(ICI) 매출이 가장 높은 이유는 거의 모든 암에 적용할 수 있기 때문에 범용성 측면에서 다른 항원을 이용하는 약물이 따라올 수 없음
이중항체(bispecific antibody), 항체약물접합체(antibody-drug conjugate, 이하 ADC), 나노항체(nanobodies) 등 차세대 항체의약품은 전통적인 단일클론 항체보다 더욱 정교하고 다양한 기전으로 작용하는 항체 치료제를 포함
#### (2) 이중항체 (Bispecific antibody)
이중항체(bispecific antibody)는 두 개의 서로 다른 항원을 인식해 동시 결합이 가능한 항체를 의미
최근 20여년간 유전자재조합, 단백질 공학, 제조 기술 등의 발전으로 인해 단일클론 항체에서 이중항체로 개발이 확대되기 시작
이중항체는 하나의 세포에 두 개의 각기 다른 에피토프에 결합하거나, 두 개의 다른 표적 세포에 동시 결합이 가능하기 때문에 단일클론 항체 대비 표적 세포에 대한 특이성이 높고 효능 또한 향상시켰다는 장점이 있음
면역세포와 암세포에 동시 결합이 가능한 이중항체는 두 세포 간 물리적인 거리를 좁혀 면역반응에 의한 암세포 사멸이 가능
글로벌 임상시험수탁기관 IQVIA(아이큐비아)에 따르면 현재 임상 개발중인 이중항체 파이프라인은 150개에 달하는데 이는 전체 혈액암 및 고형암 신약 파이프라인의 7% 비중에 해당
절반 이상이 임상 1상의 초기 단계이며, 67%는 고형암, 24%는 혈액암, 9%는 두 가지 암 종을 모두 타겟
이중항체에 대한 연구개발이 확대되며 세 개 이상의 서로 다른 항원에 결합이 가능한 삼중항체 등 다중 타겟 항체도 개발되고 있음
최근 주목받고 있는 이중항체는 PD-(L)1 x VEGF 조합으로, 한쪽은 PD-(L)1을, 다른 쪽은 VEGF를 타깃으로 함
VEGF는 혈관 내피세포 성장인자(Vascular Endothelial Growth Factor)인데, 암세포가 새로운 혈관을 만들도록 유도해 종양 성장을 도와주는 주요 인자임
따라서 VEGF를 타깃으로 억제하면 종양 주위 신생혈관 형성을 차단해 암세포 성장을 억제시켜 암 치료 효과를 극대화함
#### (3) ADC (Antibody-Drug Conjugate)
ADC(항체-약물 접합체)란 단일클론 항체에 암세포를 사멸시킬 수 있는 세포독성 약물 페이로드(payload)를 화학적 링커로 연결한 형태의 의약품
ADC가 암세포 표면의 특정 항원에 결합해 암세포 내로 흡수되면, 링커가 분해되며 세포독성 약물 방출과 함께 암세포를 사멸하는 기전
→ 링커의 안전성이 얼마나 우수하냐에 따라 성패가 결정됨
ADC는 세포독성 약물을 암세포에 직접 전달하기 때문에 정상 세포를 보호할 수 있으며 부작용을 감소시킬 수 있음
→ 다만 암세포가 사멸된 후 죽은 세포에서 세포 밖으로 유출된 약물이 세포막을 투과하여 다시 주변 세포를 사멸(apoptosis)시키는 by-stander cell-killing 현상이 일어나는 부작용 우려가 완전히 해소되지는 않았음
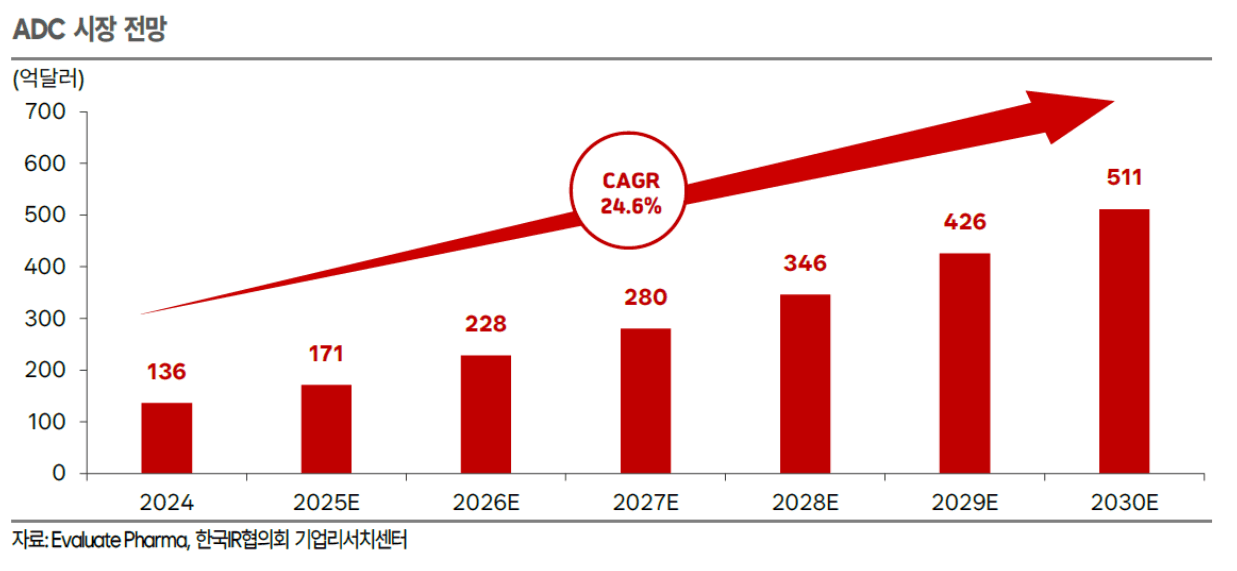
ADC는 항암제 분야에서 가장 빠르게 개발이 확대되고 있는 모달리티
Evaluate Pharma에 따르면 ADC 시장은 2024년 136억 달러(18조 7489억 원) → 2030년 511억 달러(70조 4464억 원)(CAGR 24.6%)
### 바이오시밀러 시장 규모 및 성장성
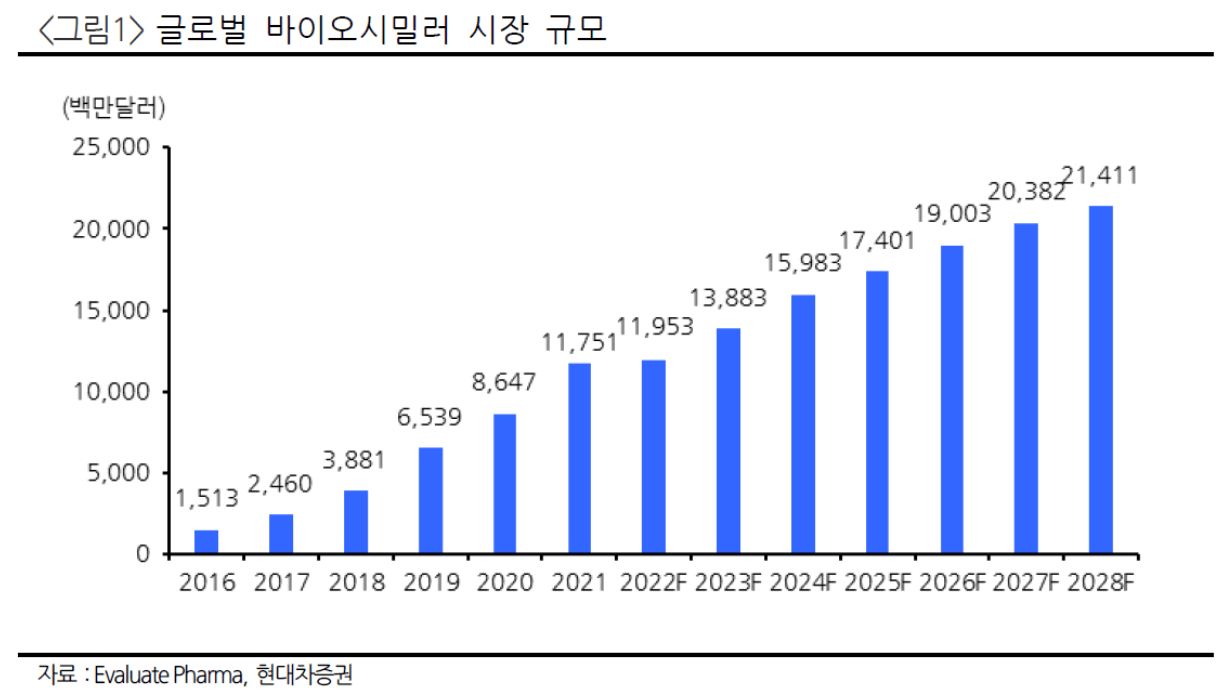
바이오시밀러 시장은 2015년 3월 6일 FDA로부터 산도즈가 세계 최초로 뉴포젠(Neupogen) 바이오시밀러 작시오(Zarxio)를 승인받으며 시작
암젠(Amgen), 화이자(Pfizer)를 포함하여 국내 셀트리온, 삼성바이오에피스 등 많은 기업들이 바이오시밀러 전문기업으로 시장에 진입
빅파마들은 할로자임 및 알테오젠과 함께 자사의 블록버스터 의약품의 오리지널 특허 만료를 대비하여 미리 피하주사(SC)를 개발 중
대표적으로 면역항암제 3대장인 머크의 키트루다, BMS의 옵디보와 렐라틀리맙, 로슈의 허셉틴과 오크레부스, 얀센의 다잘렉스, 아미반타맙 등이 모두 SC로 개발 진행중
피하주사로 시장이 재편되면 혈관주사 제형의 특허가 끝나더라도 시장 점유율을 가져올 수 없기 때문
## 기술이전(L/O) 현황
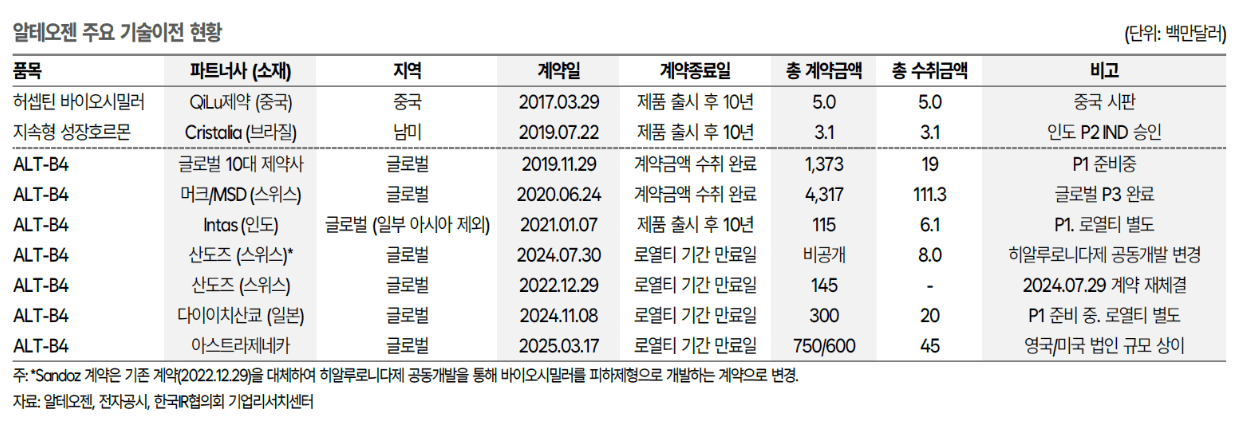
[(Click) 알테오젠(196170) - 기술이전(L/O) 현황](https://docs.google.com/spreadsheets/d/1FJN6d02btGyspxacz5eOMqP6QWJeM0fd6XyzkHzb3Ic/edit?usp=sharing)
## 투자 아이디어(Idea)
### (1) 2025년 10월 1일 '키트루다SC' 출시 예정
ALT-B4가 적용된 품목 중 첫번째로 상용화가 되는 제품은 글로벌 매출액 1위 의약품 키트루다(Keytruda)임
키트루다는 PD-1 타겟 면역항암제로 20개 암종에서 40개 적응증에 대한 허가를 획득한 글로벌 블록버스터 제품
2024년 매출액은 295억 달러(약 40조 6628억 원) 를 기록
머크는 IV제형인 키트루다의 2028년 주요 물질특허 만료를 앞두고 바이오시밀러에 대한 시장점유율 방어를 위해 알테오젠의 ALT-B4를 활용한 SC제형 개발에 나섰음
2025년 3월 27일, ELCC(유럽폐암학회)에서 키트루다 비소세포폐암 1차 치료제로 SC제형과 IV제형을 비교하는 임상3상 결과를 발표함 (2024년 11월 19일 Topline 발표 후 최종 상세 데이터)
[MSD, 키트루다 SC 비열등성 임상결과 및 허가/론칭 일정 발표 – 알테오젠](https://www.alteogen.com/ir_1/?pageid=2&mod=document&uid=2467) (2025-03-28)
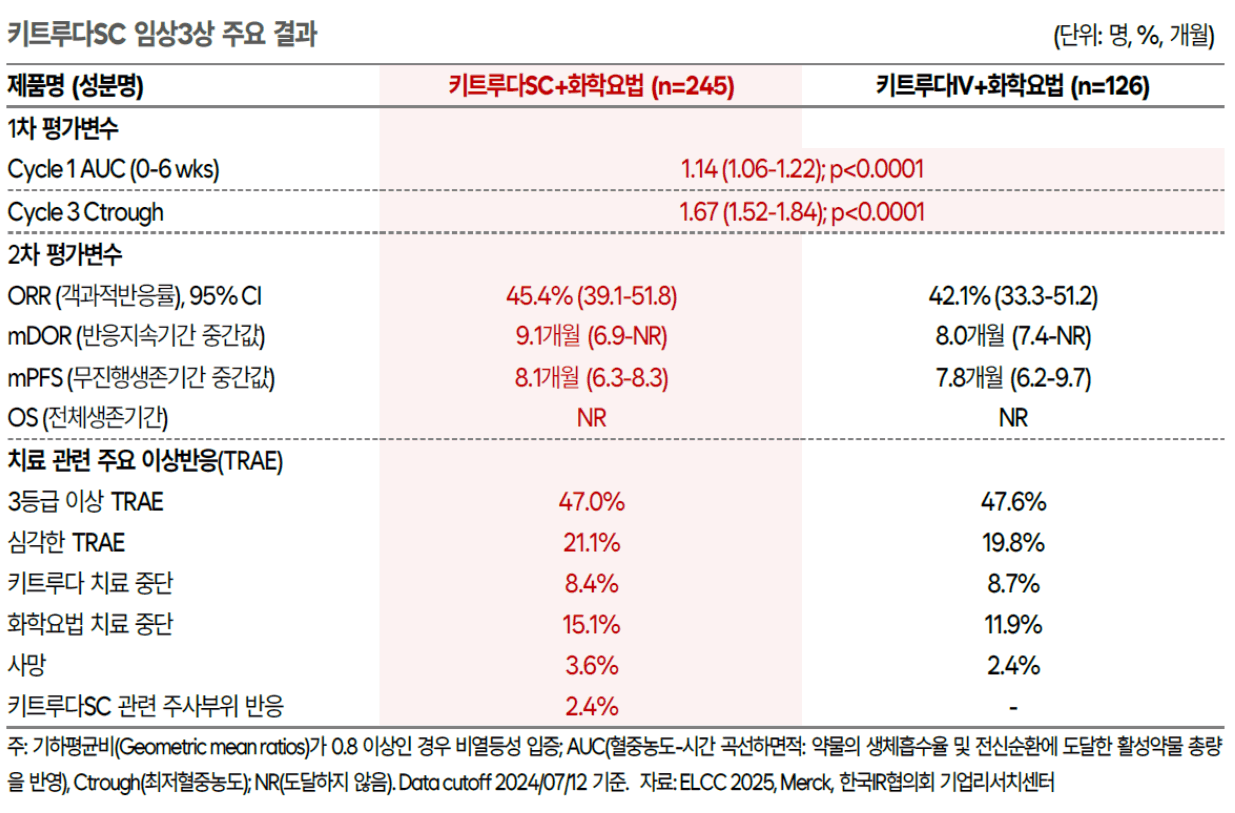
키트루다 IV 제형 대비 SC제형의 PK 프로파일을 비롯해 주요 효능 및 안전성 관련 지표 모두 비열등성을 입증
이 결과를 기반으로 FDA에 신약허가 신청서가 2025년 3월 27일 접수되어, **2025년 9월 23일 허가** 여부 확인 가능
머크는 **FDA 승인 후 일주일만인 10월 1일 출시**를 발표함
→ 얼마나 머크가 진심이고 공격적인 전략을 가져가는 지 알 수 있음
- 출시 후 12~18개월 내 전환율 30~40% 목표
- 단독요법 및 초기단계 적응증, 경구 병용요법에서 채택률 높을 것으로 기대
- 전이성 혈액암 병용요법은 채택률 낮을 것 → 이미 환자가 IV주사용 백을 걸어놓았기 때문
- permanent j-code가 발급(6개월 소요)되면 30일 이내 보험청구가 가능하기 때문에 채택률이 가속화될 것
- 특허만료(2028년) 전까지 전환율 50% 목표
- 알테오젠 내부적으로는 더 빠르게 전환될 것으로 전망하고 있음
2030년까지 전환율은 지속 증가하여 연간 20~30조원 수준 매출 추정하고 있음
알테오젠은 키트루다 SC제형 허가 획득 이후 2025년 하반기부터 2-3년 이내 허가 관련 마일스톤을 포함해 누적 매출액 조건 달성 시 1.4조원 이상의 마일스톤 유입을 예상하고 있으며, 이후에는 매출액 대비 수령하는 판매 로열티(4~6% 추정)를 받음
동사는 3년 내 마일스톤 모두 수령할 것이라고 제시
[알테오젠 최근 이슈에 대한 주주서한 (24.11.25) – 알테오젠](https://www.alteogen.com/ir_1/?pageid=1&mod=document&uid=2429) (2024-11-25)
### (2) 최초의 SC제형 ADC '엔허투SC' 상업화 기대
동사는 2024년 11월 8일 글로벌 ADC 1등 기업 다이이찌 산쿄와 엔허투 ADC를 전세계 최초로 SC로 전환하는 독점 계약 체결함
다이이찌 산쿄는 ADC 산업에 뛰어든지 단 9년만에 시장을 장악한 기업으로 2019년에 엔허투를 HER2 양성 유방암 치료제로 승인받은 이후 전세계 1등 ADC 제품이 되었음
기존 로슈 케싸일라(Kadcyla) 대비 2배 수준의 ORR(객관적 반응률)을 이뤄내며 Best-in class로 후발주자임에도 압도적 1등을 차지
2023년 전세계 글로벌 제약사 중 항암분야 매출액 상승률이 가장 높은 80%를 이루었음
엔허투는 2030년 160억 달러(22조원) 매출액이 기대되는 블록버스터 제품임
다이이찌산쿄/아스트라제네카 또한 IRA약가 인하 회피와 특허만료를 위한 방어 전략으로 SC제형이 필요함
25년 3월 주주총회 Q&A에서 동사가 답변한 내용을 보면,
엔허투SC 임상 1상 결과가 유효성과 부작용 개선 입증에 성공할 경우 ADC 전체 시장이 SC로 전환될 것으로 기대하고 있음 (ADC는 일반 항체와 달리 피부독성 이슈로 SC제형 상용화가 어렵다는 인식이 있기 때문)
[정기주주총회 주요 Q&A – 알테오젠](https://www.alteogen.com/ir_1/?pageid=1&mod=document&uid=2472) (2025-03-31)
2025년 6월 13일 엔허투SC 임상 1상 준비가 시작됨
[다이이찌산쿄(Daiichi Sankyo) 엔허투(Enhertu) SC 임상 1상 개시 – 알테오젠](https://www.alteogen.com/ir_1/?pageid=1&mod=document&uid=2506) (2025-06-13)
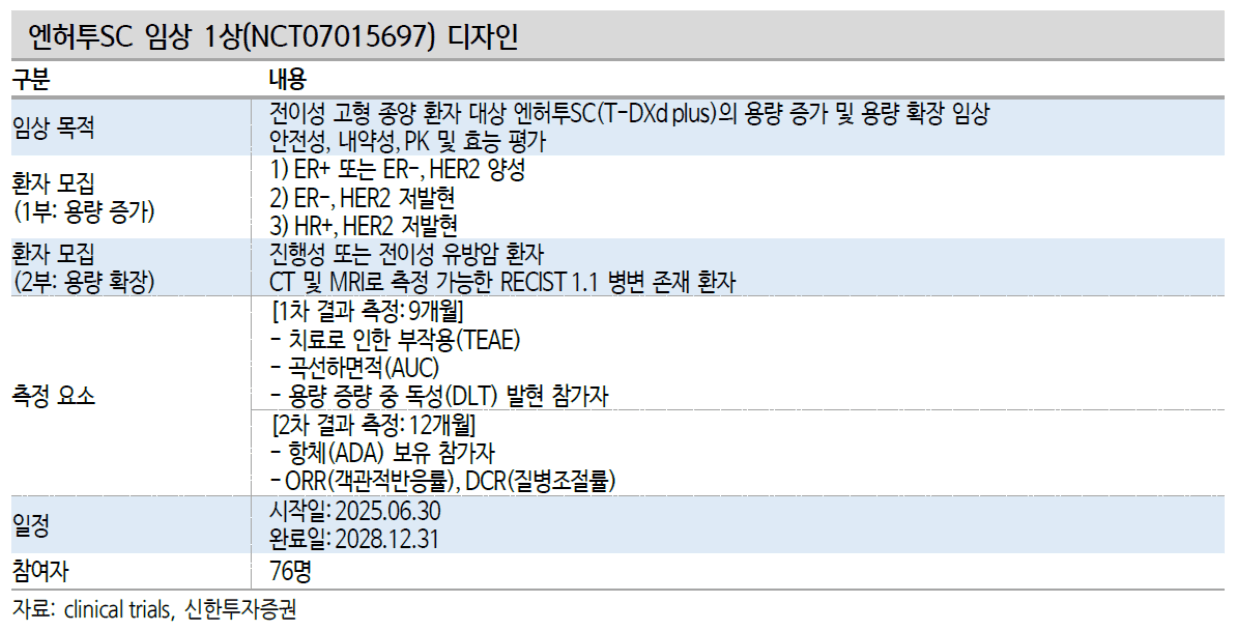
엔허투SC 임상 1상(임상번호: NCT07015697)은 총 76명의 전이성 고형암 환자 대상으로 엔허투의 용량 증량과 용량 확장, 안정성, 내약성, PK 및 효능까지 평가
JP모건 헬스케어 컨퍼런스 2025(JPMHC 2025)에서 다이이찌 산쿄는 직접 엔허투SC의 개발 사유로 유효성 개선이 목표라고 했으며, 유효성 개선의 방법으로 낮은 부작용으로 인한 높은 용량 투약 가능성을 언급함
만일 기존 엔허투IV 대비 높은 매출액을 엔허투SC가 달성한다면 추가 매출이 일어난 부분에 대해서 로열티가 높을 것으로 추정하고 있음
ADC는 독성이 있기 때문에 IV제형으로 투약할 때 너무 고용량으로 투여하면 부작용이 발생할 확률이 높아짐

위 PK data에서 빨강색 부분이 ALT-B4를 적용한 SC제형으로 농도가 치솟지 않고 적당히 유지되는 것을 볼 수 있음 (Cmax 감소)
이 결과가 엔허투SC 임상 1상 결과로 나타나면 ADC를 개발하는 글로벌 빅파마들도 SC제형을 선택할 수 밖에 없음
올해 임상1상 결과 확인 가능할 것으로 예상되며, 30% 이상 종양 감소 환자의 비율을 뜻하는 ORR 개선 여부가 중요
→ Open-Label로 임상이 진행되기 때문에 임상 결과를 미리 알 수 있음
다이이찌 산쿄 외 ADC 개발업체들도 SC제형 포트폴리오 확보 필요하므로 추가 L/O 계약이 기대됨
### (3) 하이브로자임 플랫폼 확장성 및 추가 L/O 기대
알테오젠의 하이브로자임 플랫폼이 목표하는 주요 시장은 크게 3가지로 구분할 수 있음
1. 특허 만료가 임박한 블록버스터 의약품
2. 기존 면역항암치료제, 대용량 자가면역치료제, 복합제형 치료제
3. 경쟁제품에 할로자임과 타겟 독점 계약을 체결한 치료제 (이중항체, ADC 등)
유효성이 높지만 부작용 이슈가 있는 약물(예: ADC)은 동사의 ALT-B4를 적용한 SC제형을 검토할 가능성이 높음
[\[바이오 USA\] 알테오젠, ‘ALT-B4’ 끝없는 모달리티 확장…“RNA도 적용 가능” \< 학회줌인 \< 기사본문 - 더바이오](https://www.thebionews.net/news/articleView.html?idxno=15992) (2025-06-20)
ALT-B4의 적용 범위는 항체, ADC에만 국한되지 않는다. 최근에는 이중항체, RNA 치료제와 함께 표적단백질분해(TPD) 기반의 저분자화합물(small molecule) 등 새로운 모달리티로 떠오르고 있는 분야에도 적용이 가능
>“RNA 치료제와 관련한 물질이전계약(MTA)을 체결한 파트너사로부터 데이터가 잘 나오고 있다고 보고를 받았다”며 “**RNA는 확실히 적용이 가능하다**”고 말했다.
#### 경쟁사 할로자임의 ENHANZE 특허기간 만료 임박
경쟁사인 미국의 할로자임 테라퓨틱스(Halozyme Therapeutics)는 재조합 인간 히알루로니다제 PH20(rHuPH20)을 활용해 SC 약물 전달을 촉진하는 **Enhanze 기술**을 보유하고 있음
할로자임은 Enhanze 기술로 로슈, J&J, Argenx 등 글로벌 제약사와 SC제형 개발 L/O 계약을 체결해옴
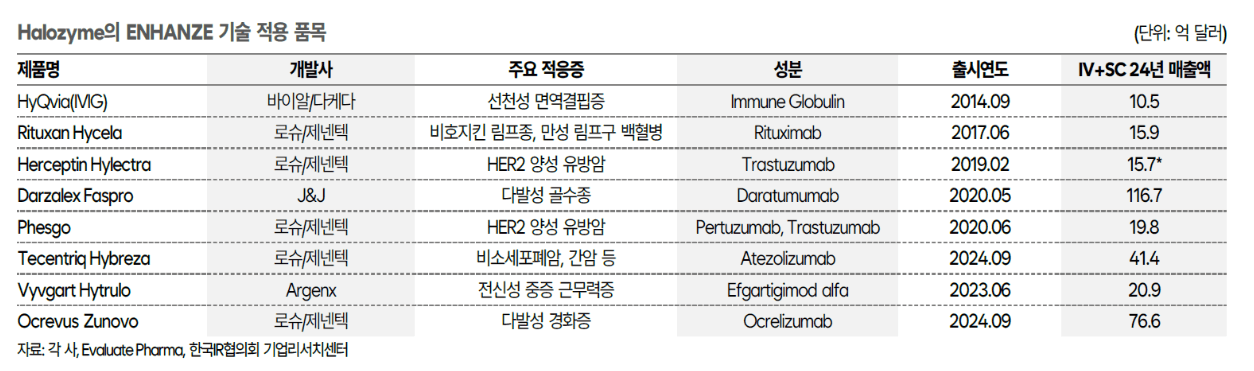
할로자임으로부터 개발된 J&J의 다잘렉스SC, 로슈의 티쎈트릭SC, BMS의 옵디보SC 모두 유효성이 개선되고 부작용이 감소되는 결과를 발표했었음
할로자임이 공개한 내용에 따르면 계약 품목 대부분 Enhanze 특허가 만료되는 2030년까지 순매출액 대비 mid-single 수준의 로열티(약 5%)를 수령하는 조건이며, 특허 만료 이후에는 로열티가 감소하는 구조라고 밝혔음
할로자임은 바이오마커 독점 계약 형태로 HER2(로슈), CD20(로슈), FcRn(아제넥스), EGFR/MET(얀센), CD38(얀센), PD-1(BMS), PD-L1(로슈), LAG-3(BMS) 등으로 각 기업이 독점 계약중인 바이오마커로 이루어진 바이오시밀러는 개발 자체가 불가능
반면 알테오젠의 ALT-B4는 미국 특허가 2025년 7월 17일 등록이 완료되어 2043년 초까지 보호 받을 수 있는 상황
#### 25년 하반기 1건 및 매년 2건 이상의 LO 목표
박순재 대표가 직접 인터뷰에서 연 2건 이상의 기술이전을 자신한다고 밝혔으며, 올해 하반기를 목표로 기술이전 협상을 진행하고 있다고 언급함
[박순재 알테오젠 대표 "빅파마, SC제형 도입 필수…年2건 이상 기술이전 목표" [김정곤의 바이오 테크트리]](https://www.sedaily.com/NewsView/2GQG4TS0QJ) (2025-03-30)
현재 물질이전계약(MTA) 맺은 것만 9~10건으로 대부분 빅파마들과 체결함
→ 25년 3월 기사에서는 MTA 8건이었으나, 25년 6월 기사에서는 빅파마 10곳으로 3개월만에 1~2건 추가
MTA 체결이 됬다면 계약 규모를 협상하는데 시간이 소요될 뿐 때가 되면 L/O가 나올 가능성이 매우 높음
2025년 4월 17일 한국경제TV에서 ADC 신약 파이프라인을 늘리고 있는 화이자, 애브비, 길리어드 등 제약사들이 이번 계약의 유력한 후보로 언급함
[알테오젠·펩트론, 기술수출 '빅딜' 터진다](https://v.daum.net/v/20250417144739102) (2025-04-17)
2025년 6월 27일 딜사이트 인터뷰에서도 올해 최소 1~2건 추가 계약을 예상한다고 언급
[\[바이오 USA\] \[2025\] 전태연 알테오젠 부사장 "올해 최소 1\~2건 추가계약 기대" - 딜사이트](https://dealsite.co.kr/articles/143670) (2025-06-27)
##### (L/O 후보 1) 면역 또는 표적 항암제 + ADC 병용요법
###### 키트루다 + 파드셉 병용요법 (방광암 1차 치료제 승인)
2023년 4월 머크 키트루다 + 화이자/시젠의 파드셉(PADCEV) 병용요법이 방광암 1차 치료제로 FDA 승인 받았음
화이자는 2023년 12월 14일 시젠을 약 430억 달러(약 56조원)에 인수 완료함 (화이자 역사상 최대규모의 투자)
[화이자, ADC 항암제 전문기업 시젠 인수 완료 - 의약뉴스](https://www.newsmp.com/news/articleView.html?idxno=238305) (2023-12-16)
→ 시젠(Seagen)의 파드셉(PADCEV)은 엔허투보다 먼저 1차 치료제로 승인된 Nectin-4 타깃의 ADC 제품
대부분의 비뇨기과 의원은 IV주사 센터를 갖추고 있지 않기 때문에 만일 PD-1 치료가 필요하다고 판단되면 비뇨기과 전문의들은 환자를 종양내과로 의뢰해야만 함
화이자가 비뇨기과 전문의들을 대상으로 조사한 바에 따르면, 간편하게 SC주사로 PD-1을 직접 투여할 수 있다면 사용하겠다고 대다수의 의사들이 답변했다고 함
즉, 키트루다SC가 나오면 파드셉 또한 SC제형이 필요함
###### 엔허투 + 퍼제타 병용요법 (유방암 1차 치료제 후보)
ASCO 2025(미국종양학회)에서 <u>HER2 양성 환자들을 대상</u>으로 '엔허투와 로슈의 퍼제타(성분명: Pertuzumab)의 병용요법'에서 '퍼제타 + 허셉틴 + 화학요법을 병용하는 3제 요법' 대비 무려 44% 사망 위험 감소를 발표
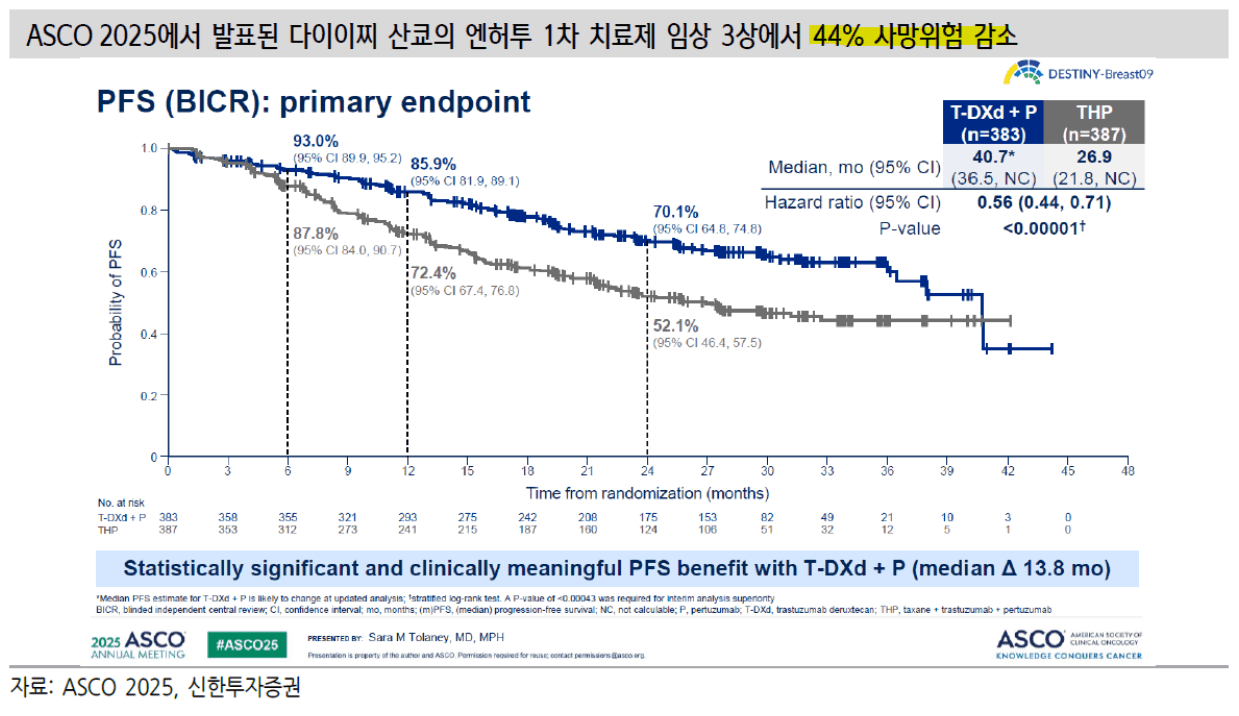
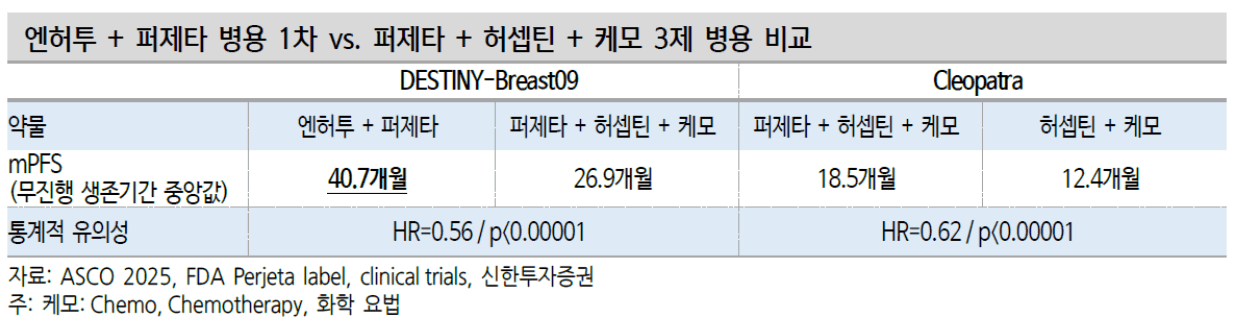
PFS(무진행 생존기간) 중앙값은 40.7개월인 반면 대조군은 26.9개월 (p<0.00001)
대조군(퍼제타+허셉틴+화학요법 3제 병용요법)의 과거 CLEOPATRA 임상에서의 mPFS 18.5개월보다 개선된 26.9개월로 나옴
그러나 엔허투가 대조군보다 사망환자가 많았음(치료 약물 관련 사망은 엔허투 5명, 대조군 1명)
→ 엔허투SC를 통해 부작용을 개선하고 용량 증대를 통해 유효성을 올리려는 이유
2025년 7월 22일 FDA에서 HER2 양성 진행성·전이성 유방암 환자 1157명을 대상으로 진행한 글로벌 임상3상(DESTINY-Breast09)의 중간 분석 결과를 근거로 이번 병용요법을 혁신치료제로 지정함
[‘엔허투+퍼제타’, HER2+ 전이성 유방암 1차 치료제로 FDA 혁신치료제 지정 \< 암 \< 기사본문 - 더바이오](https://www.thebionews.net/news/articleView.html?idxno=16658) (2025-07-22)
기존 치료제(허셉틴) 대비 사망위험 -44%, PFS 3년 이상 지속되어 기존 치료제를 대체하는 유방암 최초의 1차 치료제 ADC될 것으로 예상됨
###### 키트루다 + 트로델비 병용요법 (삼중음성유방암(TNBC) 1차 치료제 후보)
트로델비(Trodelvy)는 길리어드의 첫번째 TROP-2 ADC 항암신약임
2025년 ASCO에서 길리어드는 '키트루다(PD-1) + 트로델비(TROP-2) 병용요법'으로 진행한 삼중음성유방암(TNBC) 1차치료제 세팅 임상3상에서, 키트루다 병용 표준치료제(SoC)와 비교해 무진행생존기간(PFS)을 35% 개선한 데이터를 공개함
[길리어드, ‘트로델비+키트루다’ TNBC 3상 “PFS 35%↑” - 바이오스펙테이터](https://www.biospectator.com/news/view/25291) (2025-06-05)
키트루다 단독 사용 외에 삼중음성유방암(TNBC) 1차 치료에서 20년 만에 처음으로 등장한 새로운병용요법 후보
삼중음성유방암(TNBC)는 전체 유방암의 약 10~12%를 차지하기 때문에 중요한 적응증임
환자 절반 이상이 2차 치료까지 도달하지 못하고 사망하는데, 2차 치료로 사용되던 치료법(트로델비)이 1차 치료제가 된다면 대상 환자수가 2배 이상 늘어날 수 있음
ADC가 화학요법 병용을 대체하면서 적응증이 확장되고 있음을 의미
트로델비의 미국 특허는 2028년 10월 30일 만료이므로 트로델비SC 출시할 가능성이 높음
##### (L/O 후보 2) 이중항체 (PD-(L)1 x VEGF)
글로벌 빅파마들이 이중항체 약물에 대규모의 자금을 투자하면서 기술 확보 경쟁이 치열함
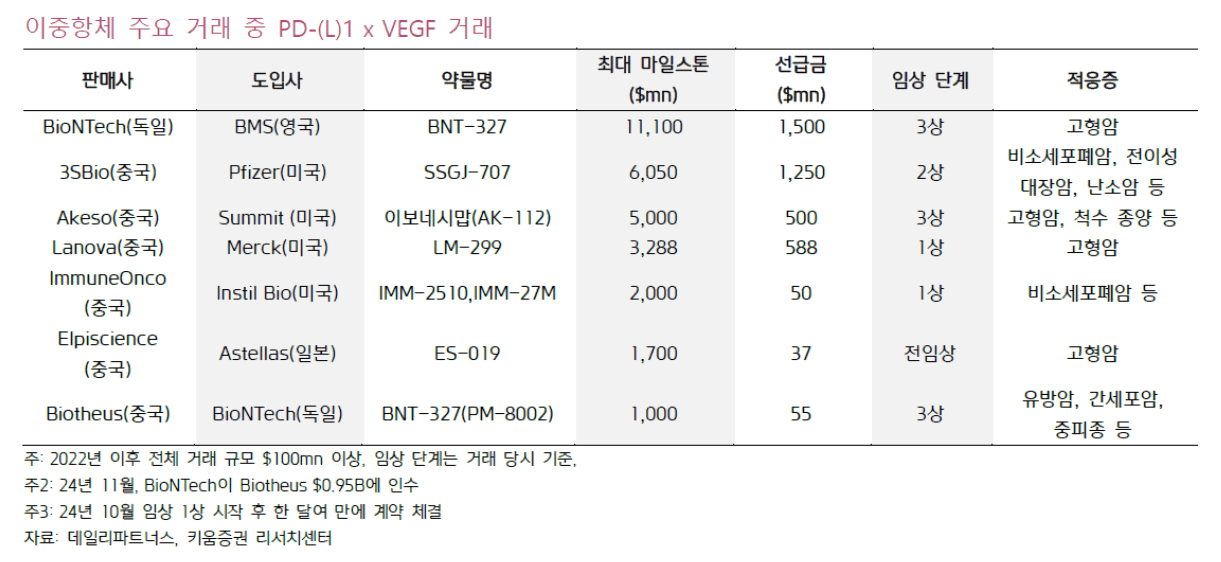
이중항체 대부분이 IV제형으로 개발되고 있지만 장기적으로 SC제형 전환을 검토하고 있음
→ 아스트라제네카는 이미 일부 이중항체 치료제에서 SC제형 개발 추진중
[PD-1/VEGF 이중항체 경쟁 가열…SC 제형 확장 가능성 '주목' \< 바이오 \< 기업 \< 기사본문 - 히트뉴스](http://www.hitnews.co.kr/news/articleView.html?idxno=66359) (2025-07-05)
###### AK-112 (PD-1 x VEGF)
세계폐암학회(WCLC 2024)에서 서밋 테라퓨틱스(Summit Therapeutics)의 PD-1 x VEGF 이중항체 이보네시맙(Ivonescimab)이 키트루다와 직접 비교한 중국 임상(HARMONi-2)에서 키트루다 대비 mPFS가 2배 더 높게 확인되면서 세계를 놀래 켰고, PD-(L)1 x VEGF 이중항체가 차세대 면역항암제로 가장 주목받는 조합이 됨
→ 키트루다에 비해 질병 진행 또는 사망 위험을 거의 절반으로 줄여줌
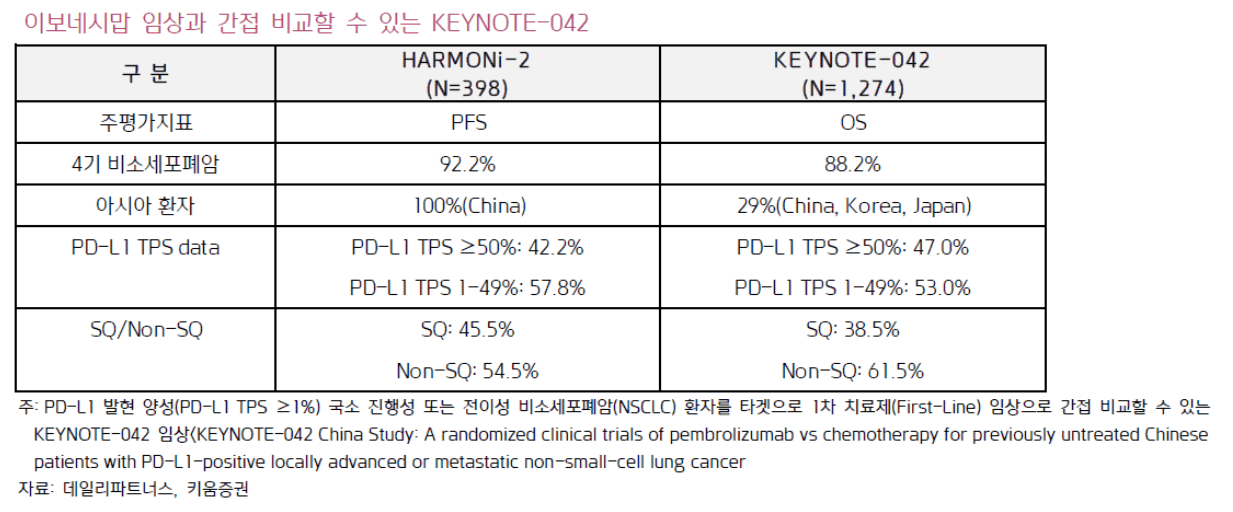
이보네시맙(Ivonescimab)은 22년 12월 아케소(Akeso) 3상 단계의 AK-112를 서밋 테라퓨틱스(Summit Therapeutics)가 계약금 $500mn, 최대 $5bn 금액으로 기술 도입한 물질임
2025년 5월 30일 Summit/Akeso는 Ivonescimab의 첫 글로벌 3상 결과를 발표함
이전에 치료 받은 EGFR(epidermal growth factor receptor) 변이 비편평 비소세포폐암(NSCLC) 환자를 대상으로 Ivonescimab과 화학 병용 요법은 질병 진행 또는 사망 위험을 48% 감소 시켰으며, 1차 평가변수인 무진행 생존기간(PFS)을 달성
그러나, 전체 생존기간(OS)에서는 통계적 유의성에 도달하지 못함(P=0.057)
25년 7월 블룸버그 통신은 아스트라제네카가 PD-1 x VEGF 이중특이성 항체인 이보네시맙에 대한 권리 확보를 위해 최대 150억 달러에 달하는 라이센스 계약을 논의중이라고 보도함
서밋 테라퓨틱스는 다른 글로벌 기업과도 계약을 논의중이기 때문에 최종적으로 아스트라제네카와 계약할 지는 지켜봐야 함
만일 아스트라제네카가 이보네시맙을 도입한다면 SC제형으로 개발할 가능성 높음
이미 PD-1 x CTLA-4 이중항체인 임핀지+트렘리무맙 병용요법의 SC제형을 알테오젠과 개발하고 있기 때문
###### LM-299 (PD-1 x VEGF)
머크는 2024년 10월 라노바(LaNova, 중국)의 LM-299(PD-1 x VEGF, 1상)를 계약금 $588mn, 최대 마일스톤 $2.7bn 에 L/I함
현재 LM-299는 임상 2상 진행중임 (임상 1상 중에 샀기 때문에 머크는 이중항체에서 후발주자)
머크는 PD-1 x VEGF 이중항체 후보물질 개발을 본격화해 10~12건의 임상시험 진행중
[MSD, ‘PD-1·VEGF’ 이중항체 병용 전략 본격화…“ADC 5\~6개 전환 검토” \< 암 \< 기사본문 - 더바이오](https://www.thebionews.net/news/articleView.html?idxno=15725) (2025-06-11)
키트루다 단독요법에서 효과가 제한적이었던 적응증에서 이중항체 적용 가능성을 확인하고 있음
글로벌 빅파마들의 이중항체 개발경쟁이 치열한 상황이기 때문에 머크 또한 시장점유율을 방어하려면 SC제형 필요
###### BNT-327 (PD-L1 x VEGF)
BMS는 2025년 6월 BioNTech과 최대 $11.1bn(선급금 $1.5bn, 비조건부 지급금 $2.0bn)에 계약하여 BNT-327(PD-L1 x VEGF, 3상) 지분 50%를 확보함
[BMS·바이오엔테크, ‘PD-L1·VEGF’ 이중항체 ‘BNT327’ 공동 개발…최대 15조 \< 기술이전·투자·IPO \< 기사본문 - 더바이오](https://www.thebionews.net/news/articleView.html?idxno=15523) (2025-06-03)
BioNTech은 2024년 11월 14일 2024 R&D Day에서 BNT-327의 SC제형 개발을 고려하고 있다고 밝힌 바 있음
과거 면역항암제 시장에서 키트루다의 선점 효과로 옵디보가 밀렸던 뼈 아픈 경험이 있기 때문에 경쟁사보다 빨리 시장에 진입하는게 얼마나 중요한 지 알고 있을 것
PD-L1은 이미 로슈(티쎈트릭SC)가 할로자임과 타겟독점으로 계약을 체결한 상태이기 때문에 BMS에게 선택지는 알테오젠 밖에 없음
BMS의 주력 제품인 옵디보 특허가 2028년 만료이기 때문에 이 시점에 맞추어 BNT-327을 상업화할 전략을 갖고 있을 것
현재 임상 3상 진행중으로 아스트라제네카가 MEDI-5752 볼루스토미그(PD-1 x CTLA-4) 임상 3상 단계에서 SC제형 개발을 알테오젠과 계약한 것처럼 BMS 또한 계약이 나올 가능성 높음
경쟁사(할로자임)의 계약사(BMS)가 알테오젠과 L/O 계약을 체결한다면 파급효과가 클 것으로 예상
###### SSGJ-707 (PD-1 x VEGF)
화이자는 팬데믹 기간에 글로벌 매출 1위였으나 2024년 5위, 2030년에는 10대 기업 중 최하위로 전망되고 있어 새로운 블록버스터 약품에 대한 니즈가 큰 상황
2025년 5월 19일 화이자가 3SBio의 SSGJ-707(PD-1 x VEGF) 이중항체 후보물질을 선급금 12억 5000만 달러(약 1조 7000억원), 마일스톤 최대 48억 달러(6조 6000억원)에 도입함 (중국을 제외한 글로벌 판권)
[화이자, 中 3SBio서 8.4조에 ‘PD-1·VEGF’ 이중항체 글로벌 판권 확보 \< 기술이전·투자·IPO \< 기사본문 - 더바이오](https://www.thebionews.net/news/articleView.html?idxno=15169) (2025-05-20)
이중항체에서 경쟁사가 SC제형에 뛰어든다면 화이자 또한 SC제형이 필요할 수 밖에 없으므로 L/O 후보임
### (4) 산도즈 SC제형 개발품목 공식화
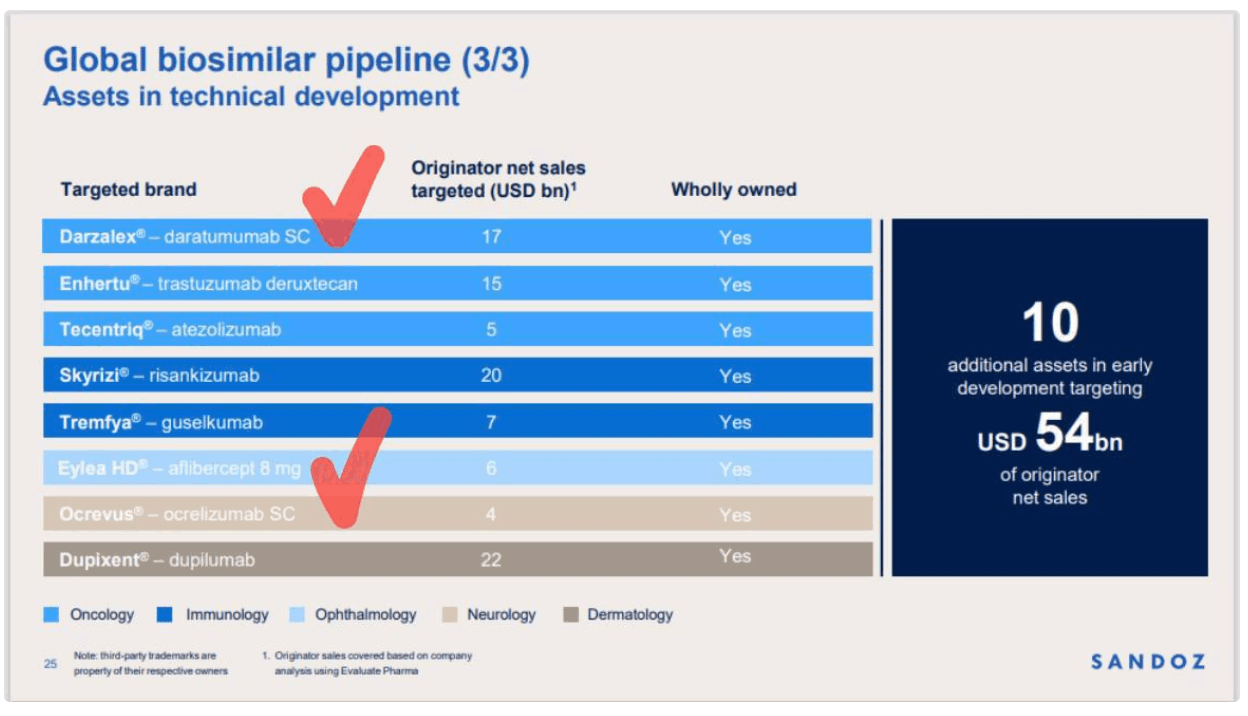
동사는 글로벌 1위 바이오시밀러 기업인 산도즈(Sandoz)와 2023년 12월 단품목 SC시밀러 계약에서 2024년 7월 30일 다품목 SC시밀러로 확대 계약으로 변경했었음
당시 품목(최소 4~5개 추정)과 조건이 비공개였으나 산도즈의 1Q25 실적발표에서 SC시밀러 품목이 공개됨
1) **J&J 다잘렉스SC 시밀러**
2) **로슈 오크레부스SC 시밀러**
유럽의약품청(EMA)는 바이오시밀러 후보물질이 분석 및 기능 수준에서 기준 제품과 높은 유사성을 보이는 경우 임상 효능 연구를 면제한다고 발표함

[EMA, 바이오시밀러 개발 간소화를 위한 가이드 초안 공개](https://www.koreabio.org/board/board.php?bo_table=report&bcate=b:0;&pg=9&idx=502) (2025-04-04)
25년 9월까지 의견 수렴하여 최종 가이드라인 확정 → 바이오시밀러 상업화 시기 단축 가능성 높음
정식 시행은 2026년 예정임
산도즈 계약은 로열티가 최소 10% 이상이기 때문에 SC시밀러 점유율 20% 가정 시 두 품목에 대해 연간 5,000억원 이상 수령 가능
나머지 2~3개 SC시밀러 품목도 후속적으로 공개될 수 있음
### (5) 코스피 이전상장

알테오젠은 이미 코스피 이전상장 요건을 모두 갖춘 상태로 회사의 의사결정만 남겨둔 상황임
그 동안 코스피 이전요구는 계속 있었지만 박순재 대표는 신중한 태도로 적절한 시기를 고민하고 있었던 것으로 추정
2025년 7월 7일 알테오젠 2대주주인 스마트앤그로스 대표 형인우가 블로그를 통해 코스피 이전을 정식 제안함
[(주)알테오젠 투자 관련 Comment (코스피 이전, 지분 변동)\_20250707 : 네이버 블로그](https://m.blog.naver.com/PostView.naver?blogId=smartngrowth&logNo=223924414648&proxyReferer=&noTrackingCode=true) (2025-07-07)
코스피 이전 시 기대되는 효과는 다음과 같음
- 코스피 지수 추종 패시브 자금 유입 (KOSPI 200, 각종 인덱스 펀드, ETF 등 편입)
- 할인율(리스크 프리미엄) 감소로 밸류에이션 강화 (저평가 해소?)
- 유동성 증가로 주가 방어력 확대
## 리스크(Risk)
### (1) 할로자임-머크 특허 분쟁 및 소송 이슈
머크는 2024년 11월 미국 특허심판원(USPTO)에 할로자임의 히알루로니다제 관련 7개의 특허에 대해 무효 소송인 Post Grant Review(PGR)을 청구
머크는 할로자임의 특허들이 과도하게 광범위하다고 주장
할로자임은 머크의 키트루다SC 제형이 자사의 특허를 침해한다고 주장하며 2025년 3월 Preliminary Response를 제출
또한 2025년 4월 24일 할로자임은 ALT-B4가 MDase 특허 15건을 침해한다고 소송 제기

머크의 PGR 청구는 키트루다SC 출시를 앞두고 사업적인 전략으로 판단되나 2026년 6월중 공개가 예상되는 PGR 결과를 포함한 특허 분쟁에 대한 내용 확인 필요
### (2) ENHANZE 바이오시밀러 출시 가능성
할로자임의 ENHANZE 특허가 2027년~2029년 사이 국가별로 만료될 예정이기 때문에 ENHANZE 바이오시밀러 등장 우려가 있음
이에 대해 전태연 부사장이 답변한 바에 따르면,
글로벌 빅파마들이 수율, 면역독성, 안전성, 독점권 확보 측면에서 바이오시밀러가 아닌 ALT-B4를 사용하고 싶다고 함
수율을 맞추는 것이 얼마나 어려운 지 기술적으로 이해하기 어렵지만, 만일 그렇다면 빅파마들도 자체적으로 개발하는 것은 리스크가 있다고 생각함
기술적으로는 ENHANZE 바이오시밀러를 개발 가능할 지 모르나 추가적인 임상, 제형 안전성 확보, 수율, 개발기간 소요 등의 문제로 비용과 시간이 들어갈 수 밖에 없음
→ 로열티 비용 아끼려다 시장 진입 자체가 늦어져 점유율을 놓치는게 더 큰 리스크
따라서 우려는 있지만 이미 검증된 ALT-B4를 선택할 가능성이 높다고 판단
## 밸류에이션(Valuation)
[(Click) 알테오젠(196170) - 밸류에이션](https://docs.google.com/spreadsheets/d/1FJN6d02btGyspxacz5eOMqP6QWJeM0fd6XyzkHzb3Ic/edit?usp=sharing)
현재 시총 약 25조원은 키트루다SC, 테르가제, 엔허투SC 임상 기대감 정도만 반영한 것으로 판단
키트루다SC의 매출 전망이 20조원 ~ 30조원 규모이기 때문에 로열티 5%, 원료 매출 등 연간 1조원 이상 유입 기대됨
(28년 키트루다 매출 약 40조원 x SC 전환율 50% x 로열티 5% = 약 1조원)
경쟁사 할로자임의 경우 2020년부터 로열티 수입이 본격화되어 20년 1219억원, 21년 2805억원, 22년 4960억원, 23년 6162억원, 24년 7856억원 달성 중
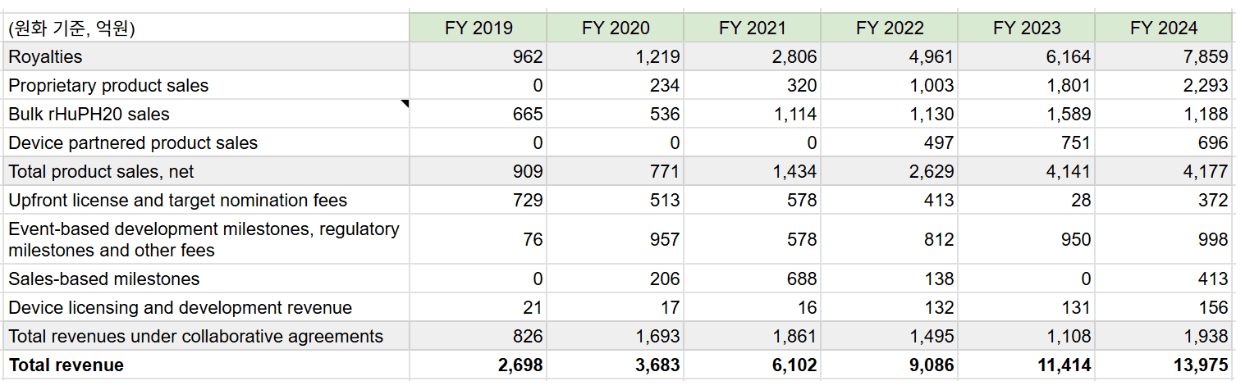
할로자임은 타겟독점이고 특허만료(2030년)가 다가오기 때문에 TAM이 알테오젠보다 작을 수 밖에 없음
할로자임의 평균 PER이 20배 수준인데, 알테오젠은 특허만료가 2043년이고 향후 추가 L/O, SC 계약품목 상업화 등을 고려하면 PER 25배가 적정하다고 생각
키트루다SC만 보더라도 시총 20조 ~ 25조 구간에서 매수는 안전마진이 있는 자리
알테오젠의 가치는 향후 이벤트에 따라 평가가 달라질 것으로 추정
1. 키트루다SC 상업화
2. 머크 5개 SC 후속물질 개발
3. 엔허투SC 임상1상 결과 발표
4. ADC, 이중항체 L/O 계약체결
5. 임핀지SC 상업화
6. 다잘렉스SC 바이오시밀러, 오브레부스SC 바이오시밀러 임상1상 개시
애널리스트 목표가는 40만원 ~ 73만원 형성
댓글 0

첫번째 댓글을 남겨주세요